XVI.Fiches espèces Bondrée apivore Busard cendré Busard des

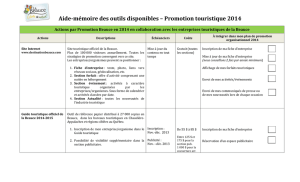
ZONE DE PROTECTION SPECIALE PETITE BEAUCE – DOCUMENT D’OBJECTIFS
SEPTEMBRE 2010
178
XVI.
Fiches espèces
Bondrée apivore
Busard cendré
Busard des roseaux
Busard Saint-Martin
Caille des blés
Cigogne blanche
Chouette chevêche
Faucon émerillon
Faucon pèlerin
Hibou des marais
Locustelle luscinioïde
Martin pêcheur
Milan noir
Milan royal
Oedicnème criard
Outarde canepetière
Perdrix grise
Pic noir
Pluvier doré
Sarcelle d’été
Vanneau huppé

179
LA BONDREE APIVORE
Pernis apivorus (Linné, 1766) En Petite Beauce
Code Natura 2000 : A072 Est présente dans la ZPS de fin avril à fin
septembre
Statut de conservation
Non chassable
Annexe I de la Directive CEE Oiseaux
Annexe II e de la Convention de Berne
Annexe II de la convention de Bonn
Annexe C1 du règlement CEE CITES.
Article 411-1 du code de l’environnement et article 1er
de l’arrêté modifié du 17/04/1981
Statut :
• En France : Migratrice commune, nicheuse peu commune.
• En Loir-et-Cher : Nicheuse estivante peu commune, migratrice commune.
• En Petite Beauce : Nicheuse rare, migratrice commune.
• Description de l’espèce :
De par sa taille (longueur : 52 à 60 cm, envergure : 125 à 145 cm, poids : 600 à 960 g ) et son costume varié, elle
est difficile à distinguer de la buse variable. Le dessus, les cotés de la tête et du cou sont gris cendré
chez le mâle, plus bruns chez la femelle. Le dessus du corps est brun foncé uniforme. En dessous,
elle peut être de sombre à presque entièrement blanche, avec tous les intermédiaires possibles. Sa
silhouette est plus élancée que la buse du fait de la proéminence de son cou typiquement plus fin, de
sa tête plus petite (un peu comme un coucou) et de sa queue plus longue aux coins arrondis,
légèrement échancrée. Le bec est noirâtre à base inférieure jaune et les pattes sont jaunes. La
perception du jaune orange de son iris est possible mais nécessite une observation rapprochée.
Photographie : source DIREN Centre
En vol le meilleur critère d’identification est la bande marginale noire au bord de l’aile. Lors des
planés, ses ailes, plus étroites, sont rectilignes, un peu plus abaissées que la buse mais le dessin
typique triplement barré de sa queue, ne se révèle que par bon éclairage. En vol battu, elle est plus
souple que la buse et manœuvre souvent sa queue. Son vol nuptial est par contre un critère précieux
pour son identification : Joignant les ailes au dessus de son corps, la bondrée « applaudit ».

180
• Distribution et effectif
Au niveau mondial, la Bondrée apivore occupe tout le Paléarctique jusqu’à l’Ouest de la Mongolie,
à l’exception du nord de la Péninsule Scandinave, de l’Islande, des environs de la Mer Noire et des
parties méridionales de l’Espagne et de l’Italie. A l’est, elle est remplacée par une espèce proche. Il
s’agit d’un migrateur au long cours qui passe la majeure partie de l’année en Afrique, de septembre à
avril. La population serait de plus de 500000 couples.
En Europe de l’Ouest, Russie et Turquie exceptés, l’estimation serait comprise entre 30000 et
50000 couples. (Ferguson-Lees J et Christie D.A, 2001 Raptors of the World, Les Rapaces de France 2004 JM Thiollay, V
Bretagnolles).
Guide encyclopédique des Oiseaux du paléarctique occidental
Mark Beaman et Steve Madge (Nathan).
En France, la bondrée est commune et présente dans toutes les régions, à l’exception des zones de
basse altitude du Bassin méditerranéen et de la Corse avec une progression dans le midi. L’effectif
national qui ressort de la dernière enquête rapaces 2000, est compris entre 10600 et 15000 couples
territoriaux.
Carte de France extraite de Rapaces nicheurs de France, Jean-Marc Thiollay et Vincent Bretagnolle chez Delachaux et Niestlé,
avec l’aimable autorisation de leurs auteurs et de l’éditeur.

181
En Région Centre, elle est bien présente notamment en Sologne.
En Loir-et-Cher, elle est largement répandue sur le territoire. La Sologne qui héberge une grande
partie des effectifs, figure parmi les meilleures régions françaises pour l’espèce. L’analyse des
résultats locaux de l’enquête nationale rapace 2000-2002, conduit à y retenir un effectif de 450 à 500
couples.
LEGENDE :
Blanc : pas d’observation
Gris clair : Commune présentant uniquement un indice de contact
Gris foncé : Commune présentant au moins un indice de reproduction
Source carte : L’avifaune de Loir et Cher, inventaire communal 1997-2002
Dans la ZPS Beauce, elle est nicheuse très localement en dehors de l’arc forestier de Vendôme à
Marchenoir et a été notée, cantonnée, sur les communes de Fossé, Averdon, Lancôme, Selommes
Marchenoir. Elle la traverse aussi chaque année et parfois y stationne quelques jours durant ses
longs voyages aller et retour vers l’Afrique. Elle a tété observée sur plus de la moitié des communes
de la ZPS.
la Bondrée apivore dans la ZPS Petite Beauce entre 1999 et 2008 : Total des observations par commune
0
5
10
15
20
25
Averdon
Baigneaux
Boisseau
Champigny en Beauce
Conan
Rhodon
Maves
Epiais
Herbault
Lancôme
Landes le Gaulois
Marolles
Mulsans
Oucques
Périgny
Saint Amand Longpré
Saint Bohaire
Saint Léonard
Marchenoir
Saint Lubin
Selommes
Villefrancoeur
Villemardy
Villeromain
Villerbon

182
• Habitat
La Bondrée apivore n’est pas liée à un biotope particulier, sa présence étant déterminée par
l’abondance des hyménoptères (guêpes, abeilles..). Elle niche au cœur de grands massifs forestiers
de feuillus et de conifères et non en périphérie comme la buse. On la rencontre dans les forêts de
grands arbres avec des clairières, des coupes ou de larges chemins. Elle chasse aussi dans les
prairies, les friches, sur les talus herbeux, les bords de marais mais évite les vastes étendues
uniformes de terres cultivées. Les meilleures densités sont de un couple pour plusieurs centaines
d’hectares boisés, voire mille hectares. Elle est présente en plaine et jusqu'à 1 500 mètres d'altitude.
Durant la migration, elle se contente d'habitats plus diversifiés. Sa distribution estivale montre une
certaine préférence pour les climats tempérés, même assez humides.
• Biologie/écologie
Cycle annuel dans la ZPS Petite Beauce:
Sa présence constante comme espèce nicheuse, n’excède pas 4 mois dans la ZPS. Ces quelques
oiseaux là, arrivent dans la première décade de mai et s’installent discrètement. Par contre ce sont
les oiseaux de passage, qui y sont très remarqués durant les phases migratoires prénuptiales et
postnuptiales, d’abord fin avril début mai puis fin juillet et tout le mois d’août. Les stationnements
dans les chaumes y sont parfois spectaculaires et déroutants, la bondrée étant parfois confondue
avec les busards et d’autres rapaces.
La Bondrée apivore dans la ZPS Petite Beauce de 1992 à 2008 : Total des observations par mois
0
10
20
30
40
50
60
Janvier Février Mars Avril Mai Juin Juillet Août Septembre Octobre Novembre Décembre
Biologie de reproduction
Le nid, appelé aire, édifiée sur une grosse branche ou une fourche à 10 ou 20 m du sol, se distingue
de celle de la buse par l’abondance de feuillage rechargé régulièrement. Les deux adultes participent
à la construction et à l’élevage des jeunes dans une grande discrétion. La ponte, 2 œufs en général,
a lieu surtout dans la première quinzaine de juin. Les éclosions interviennent début juillet, après 30-
35 jours d’incubation. Les jeunes restent au nid au moins 40 jours et les premiers envols sont tentés
après la mi août. Les jeunes restent sur le site un quinzaine de jours pour décortiquer les nids
d’hyménoptères encore apportés par les adultes. La migration commence aussitôt après. La brièveté
du séjour des bondrées apivores en Europe est permise par des adaptations originales : La
possibilité d’arriver sur les lieux de reproduction en couples déjà appariés, de construire un nid et de
pondre en une dizaine de jours seulement, puis de quitter les lieux de nidification avec les jeunes
moins de quinze jours après l’envol, en réalisant une migration rapide et groupée directement jusqu’à
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
1
/
110
100%