Le syndrome de Marfan - John Libbey Eurotext

Mini-revue
Le syndrome de Marfan
Guillaume Jondeau, Delphine Detaint, Florence Arnoult, Mathieu Gauthier, Gabriel Delorme,
Catherine Boileau
Département de cardiologie, centre de référence sur le syndrome de Marfan et apparentés, hôpital Bichat,
46, rue Henri-Huchard, 75018 Paris, France
Résumé
.
Le syndrome de Marfan associe des signes cliniques de différents
appareils : cardiovasculaires (dilatation aortique, risque de dissection,
prolapsus valvulaire mitral), ophtalmologiques pouvant conduire à la
cécité, rhumatologiques, dermatologiques, neurologiques. Il est d’origine
génétique, lié le plus souvent à une mutation du gène codant pour la
fibrilline de type 1. Ces dernières années, la physiopathologie s’est enrichie
de l’implication de la voie de signalisation TGF-bêta. Le récepteur spécifi-
que peut être anormal dans certains cas, cette voie semble paradoxalement
activée dans la paroi aortique. Son blocage chez la souris limite la
dilatation aortique, et les études chez l’homme sont en cours. En attendant
ces progrès, l’attitude actuelle reste basée sur les bêtabloquants, la sur-
veillance régulière du diamètre aortique et la chirurgie préventive, le plus
souvent, maintenant, avec préservation de la valve aortique. L’espérance
de vie des patients a déjà gagné 30 ans et pourrait encore gagner
beaucoup, ainsi qu’en qualité de vie, dans les années à venir.
Mots clés :syndrome de Marfan, TGF-bêta, mutation génétique, paroi aortique
Abstract
Marfan’s syndrome
Marfan’s syndrome is characterised by clinical signs of different systems:
cardiovascular (aortic dilatation, risk of dissection, mitral valve prolapse),
ophthalmological with risk of blindness, rheumatological, dermatological
and neurological. It is a genetic disorder, usually related to a mutation of
the gene coding for type 1 fibrillin. The physiopathology has been clarified
over the last few years by the implication of the TGF-beta signalling
pathway. The specific receptors may be abnormal in some cases; this
pathway seems paradoxically activated in the aortic wall. Its blockade in
the mouse limits aortic dilatation and clinical studies are underway. While
waiting for these results, present management is based on beta blocker
therapy, regular checks of the aortic diameter and preventive surgery,
usually with preservation of the aortic valve. The life expectancy of these
patients has already increased by 30 years and this could continue in the
future with an improved quality of life.
Key words:Marfan’s syndrome, TGF-beta, aortic valve, genetic mutation
Sang Thrombose Vaisseaux 2008 ;
20, n° 10 : 511-20
STV, vol. 20, n° 10, décembre 2008 511
doi: 10.1684/stv.2008.0338
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

Le syndrome de Marfan est une maladie génétique
dominante autosomique, généralement en rap-
port avec une mutation du gène de la fibrilline de
type 1. C’est la plus fréquente des maladies
monogéniques responsables d’anévrisme de l’aorte ascen-
dante. La compréhension de sa physiopathologie a beau-
coup évolué ces dernières années, ainsi que sa prise en
charge et son pronostic. Une étude débute, qui évalue le
bénéfice du losartan chez les patients présentant un syn-
drome de Marfan à la suite des avancées obtenues dans le
modèle animal (souris KI).
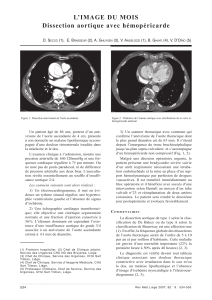
Sur le plan cardiovasculaire, elle se traduit par une faiblesse
de la paroi aortique qui se dilate progressivement au cours
de la vie et risque de se disséquer : avant que la chirurgie de
remplacement de la racine de l’aorte ne soit réalisée (inter-
vention de Bentall), les patients mourraient à 80 % des
conséquences de la dilatation aortique (dissection ou fuite
aortique avec insuffisance cardiaque), et la moitié des pa-
tients décédaient avant l’âge de 40 ans. Depuis que la prise
en charge médicale et chirurgicale a été optimisée, l’espé-
rance de vie des patients a augmenté de plus de 30 ans. Un
volet fondamental est donc la chirurgie de remplacement de
la racine de l’aorte qu’il va falloir proposer à temps pour
éviter que les complications ne surviennent, mais pas trop
précocement afin d’éviter au patient de prendre un risque
inutile (certains patients présentant un syndrome de Marfan
ne sont jamais opérés et s’en trouvent très bien). On tend
actuellement à préserver les valves natives et ainsi éviter le
traitement anticoagulant au long cours et les complications
des valves mécaniques.
La deuxième complication cardiovasculaire classique de la
maladie est le prolapsus valvulaire mitral qui peut égale-
ment relever d’une intervention chirurgicale.
Le syndrome de Marfan peut également se compliquer sur
le plan ophtalmologique (décollement de rétine, cécité,
glaucome) et orthopédique ou rhumatologique : en dehors
de la scoliose qui peut justifier une intervention chirurgi-
cale, les complications articulaires, notamment douloureu-
ses, viennent maintenant au premier plan du tableau depuis
que l’on voit des patients plus âgés.
Critères diagnostiques
Le syndrome de Marfan est, à ce jour, défini par des critères
essentiellement cliniques (établis à Ghent) publiés en 1996
et qui font toujours référence [1]. Ces critères sont comple-
xes et témoignent de la difficulté diagnostique (figure 1A).
Pour parler de syndrome de Marfan, il faut retrouver une
atteinte de 3 systèmes avec au moins 2 signes majeurs. Cela
illustre la nécessité de la collaboration de multiples spécia-
listes pour porter le diagnostic (tableau I).
L’importance des critères cliniques dans la définition de la
pathologie illustre les limites floues de ce syndrome : des
mutations de la fibrilline, mais également du gène codant
pour le récepteur 2 et peut-être du récepteur de type 1 du
TGF-bêta peuvent donner des tableaux plus ou moins com-
plets. Parfois, aucune mutation n’est retrouvée.
La fréquence des différents signes cliniques est donnée à
titre d’illustration pour les patients qui se sont présentés au
centre de référence et chez lesquels un diagnostic de certi-
tude a été porté. L’atteinte rhumatologique est la plus
fréquente : l’arachnodactylie est présente chez 80 % des
patients (signe du poignet ou signe du pouce), un pectus
chez plus de 50 %, la dolichosténomélie chez 1/3 (rapport
envergure/taille > 1,05). Les autres signes sont plus rares.
Les douleurs rachidiennes sont les complaintes les plus
fréquentes qui justifient en règle un simple traitement phy-
tothérapique et symptomatique. La surveillance est dictée
par les symptômes.
L’atteinte ophtalmologique est dominée par l’ectopie du
cristallin (65 % des patients) et la cornée plate (40 % des
patients). La myopie forte est plus rare. La surveillance doit
être annuelle du fait du risque de déplacement du cristallin
qui peut se compliquer de cécité. On peut proposer alors
une intervention préventive d’ablation du cristallin.
L’atteinte cutanée est présente surtout dans les formes
complètes, et l’atteinte pulmonaire (pneumothorax) est
rare.
La multiplicité des signes cliniques et des systèmes atteints
souligne l’importance, pour porter le diagnostic, de la réu-
nion de l’avis de différents spécialistes. Du fait de la grande
variabilité des signes cliniques, l’évocation du diagnostic
devrait être systématique devant tout anévrisme ou dissec-
tion de l’aorte, et ce, d’autant plus que l’origine athéroma-
teuse est moins probable. On devrait donc faire un bilan à la
recherche d’une atteinte des différents appareils et une
enquête familiale pour rechercher d’autres anévrismes dans
la famille.
Atteinte cardiaque
La gravité du syndrome de Marfan vient du risque de
dissection aortique qui lui est associé. La dissection aorti-
que est, ici, précédée d’une dilatation aortique, si bien que
le diamètre aortique est le meilleur marqueur du risque de
dissection que présente un patient.
Histologie
Sur le plan histologique (figure 1B), la paroi d’un patient
présentant un syndrome de Marfan est identique à la paroi
aortique d’un patient présentant un anévrisme de l’aorte
STV, vol. 20, n° 10, décembre 2008
512
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

ascendante d’autre origine. La disparition des cellules mus-
culaires lisses, la fragmentation des fibres d’élastine, l’ap-
parition de zones acellulaires riches en polysaccharides ne
permettent pas d’orienter le diagnostic. L’aspect histologi-
que est également identique en cas d’anévrisme associé à
une bicuspidie de la valve aortique ou est observé en cas
d’anévrisme sur valve tricuspide, sans facteur familial,
chez les sujets plus âgés. Ainsi, le diagnostic de maladie de
Marfan ne peut pas être porté sur l’histologie.
Physiopathologie
Elle a beaucoup évolué ces dernières années [2].
Conception classique
La fibrilline de type 1 intervient lors de la mise en place des
fibres d’élastine, pour lesquelles elle pourrait jouer un rôle
de « tuteur ». L’anomalie de la fibrilline entraînerait donc
directement une anomalie des fibres d’élastine. L’anomalie
des fibres d’élastine explique la fragilité de la paroi aortique
des patients, qui est également « rigide » avec perte de son
élasticité. Cela reste vrai aujourd’hui.
On a également proposé que l’anomalie de la fibrilline soit
responsable d’une anomalie de la transmission des forces à
la cellule musculaire lisse, qui, de ce fait, libère des métal-
loprotéases qui détruisent la paroi. Cette théorie reste d’ac-
tualité.
Importance de la voie du TGF-bêta
De grandes ouvertures ont été obtenues grâce à un modèle
de souris KI pour une mutation humaine de la fibrilline de
type 1. Cette souris développe des anomalies proches des
anomalies observées chez les patients présentant un syn-
drome de Marfan (figure 2A et B). Notamment, une dilata-
tion aortique survient avec une désorganisation de la struc-
Tableau I.Critères diagnostiques du syndrome de Marfan selon De Paepe et al. [1]
Système Signes cliniques majeurs Signes cliniques mineurs Définition de l’atteinte
du système
Squelettique –Pectus carinatum ou excavatum
nécessitant la chirurgie
– Rapport segment supérieur sur segment
inférieur bas ou envergure sur taille
> 1,05
– Signe du poignet ou du pouce
– Scoliose > 20 ou spondylolisthésis
– Extension maximale des coudes < 170
– Pied plat
– Protrusion acétabulaire
–Pectus excavatum modéré
– Hyperlaxité ligamentaire
– Palais ogival avec chevauchement
des dents
– Faciès
Majeure : si au moins
4 signes cliniques majeurs
sont présents
Oculaire Ectopie cristalline – Cornée plate Présence d’au moins
2 signes mineurs
– Globe oculaire allongé
– Iris hypoplasique ou hypoplasie du
muscle ciliaire
Cardiovasculaire – Dilatation de l’aorte ascendante
intéressant les sinus de Valsalva
– Dissection aortique
– Insuffisance aortique
– Prolapsus valvulaire mitral avec ou sans
fuite
– Dilatation de l’artère pulmonaire avant
l’âge de 40 ans
– Calcifications de l’anneau mitral avant
l’âge de 40 ans
– Anévrisme ou dissection de l’aorte
abdominale avant l’âge de 50 ans
Présence d’au moins
1 signe mineur
Pulmonaire – Pneumothorax spontané Présence d’au moins
1 signe mineur
– Bulle apicale
Cutané – Vergetures (à l’exclusion de : grossesse,
perte de poids)
Présence d’au moins
1 signe mineur
– Hernies récidivantes
Dure-mère Ectasie de la dure-mère lombosacrée Présence d’1 signe majeur
Génétique – Un parent direct ayant les critères
diagnostiques
– Mutation de FBN1 déjà connue pour
provoquer un MFS
– Présence d’un marqueur génétique
proche du gène de la fibrilline de type I,
se transmettant avec la maladie dans la
famille
STV, vol. 20, n° 10, décembre 2008 513
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

ture de la paroi. Les fibres d’élastine sont rompues,
l’épaisseur de la paroi est augmentée. Dans ce modèle, dans
lequel surviennent également un prolapsus valvulaire mi-
tral avec épaississement des valves, un emphysème pulmo-
naire et une myopathie squelettique, la voie du TGF-bêta
semble être activée de façon inappropriée.
Le TGF-bêta est une cytokine, synthétisée par les cellules
musculaires lisses sous forme de dimère (figure 3). Cette
molécule est stockée au niveau des microfibrilles, et
notamment de la fibrilline 1. Elle se fixe sur des récepteurs
de type 2 (TGFBR2) qui s’associent aux récepteurs de
type 1 (TGFBR1). Ces derniers se phosphorylent et phos-
phorylent la smad-2 intracellulaire. Smad-2 est un intermé-
diaire intracellulaire qui va être transloqué dans le noyau
une fois phosphorylé, en association avec d’autres molécu-
les, où il va modifier l’expression de certains gènes, notam-
ment ceux codant pour des protéines de la matrice extra-
cellulaire.
Dans le modèle de souris Marfan, KI pour une mutation
humaine de la fibrilline de type 1, le taux de smad-2
phosphorylé est élevé dans les cellules musculaires lisses
de la paroi aortique notamment. Plus intéressant, le blocage
de la voie du TGF-bêta par un anticorps anti-TGF-bêta
permet de limiter la dilatation aortique chez les souriceaux.
Enfin, le même résultat peut être obtenu en donnant aux
souriceaux du losartan. Cette molécule bloque la dilatation
aortique, diminue le nombre de cellules dans lesquelles le
smad-2 est phosphorylé. Pour expliquer ces résultats, on
imagine que la fibrilline anormale ne permet plus le stoc-
kage du TGF-bêta. Celui-ci est libéré et peut alors se fixer
sur ses récepteurs [3].
La grande question est de savoir si les patients présentant un
syndrome de Marfan pourraient bénéficier de cette théra-
peutique. Diverses études sont en cours à travers le monde,
qui donneront une réponse dans quelques années. Une
étude a lieu en France comparant le placebo et le losartan en
double insu, en plus du traitement classique. Pour l’instant,
les données préliminaires, rapportées par les promoteurs de
la théorie, sont encourageantes.
Se pose tout de même la question de la spécificité de cette
observation : le taux de smad-2 phosphorylé est augmenté
dans des parois aortiques de patients présentant une muta-
tion de la fibrilline, mais également chez les patients por-
teurs d’une mutation du récepteur 2 du TGF-bêta, dont on
sait qu’elle bloque la transmission du signal. Chez ces
patients, la stimulation de la voie du TGF-bêta est inatten-
due et actuellement complètement inexpliquée.
Clinique
L’atteinte aortique prédomine sur la partie initiale de
l’aorte : la dilatation est généralement maximale au niveau
des sinus de Valsalva. Cela est vrai lorsque la mutation en
cause est une mutation du gène de la fibrilline, mais égale-
ment une mutation des récepteurs du TGF-bêta.A l’inverse,
en cas de bicuspidie, la dilatation aortique est maximale
au-dessus de la jonction sinotubulaire et prédomine sur la
convexité. Les raisons en sont mal connues.
La dilatation aortique est un des critères majeurs du dia-
gnostic de la maladie, et la reconnaître est donc fondamen-
tal. Il faut donc que cette mesure soit standardisée pour que
la reproductibilité soit maximale (figure 4). Les normes les
plus utilisées sont celles publiées par Roman et al. en 1989,
même si elles sont établies à partir d’une petite population.
Elles sont probablement imparfaites, surtout chez les en-
fants pour lesquels on peut conclure à tort à une dilatation
aortique. La figure 4 montre la technique de mesure à
A
Figure 1A.Forme typique de Marfan.
STV, vol. 20, n° 10, décembre 2008
514
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

utiliser, en voie parasternale, en incluant la paroi antérieure
et non la paroi postérieure, en s’assurant de mesurer le
diamètre perpendiculairement à l’axe de l’aorte. Cette me-
sure généralement réalisée par échographie (et fiable) peut
parfois être difficile, et il faut alors la réaliser avec une autre
technique en appliquant les mêmes règles. Notamment, la
mesure effectuée sur des coupes de scanner horizontales,
sans reconstruction conduit à des mesures de diamètres
erronées.
On doit garder en tête qu’une dilatation aortique modérée
est compatible avec un diamètre aortique restant dans les
valeurs normales : si l’aorte a un diamètre avant toute
dilatation exactement à la valeur moyenne de la population
générale, elle ne sera considérée comme dilatée que si elle
dépasse 2 écarts-types. Cela est surtout important pour ne
pas considérer que l’atteinte aortique est absente, si le
patient présente d’autres signes, et ne pas, à tort, le priver du
traitement préventif de la dissection.
Dissection de l’aorte
La dissection aortique survient très généralement au niveau
de l’aorte ascendante, mais peut s’étendre au niveau de la
crosse, des vaisseaux du cou et de l’aorte descendante. La
dissection de l’aorte descendante sans dissection de l’aorte
ascendante est plus rare. Elle risque de se compliquer d’une
dilatation progressive qui imposera une intervention. En
revanche, la dissection des vaisseaux du cou, des artères
digestives, rénales, des membres inférieurs est l’extension
d’une dissection aortique, et la maladie ne prédispose pas à
la dissection des vaisseaux cérébraux.
La dissection de l’aorte ascendante a d’autant plus de risque
de survenir que :
B
Figure 1B.Aspect histologique de la paroi aortique normale (à gauche) et chez un patient présentant un syndrome de Marfan (à droite) :
les fibres d’élastine, en vert sont fragmentées et désorganisées. Des zones acellulaires sont présentes. Sur la coloration en éosine et bleu
alcian (en bas), les zones acellulaires riches en mucchopolysaccharides sont bien visibles et expliquent la fragilité de la paroi aortique
(U698 Bichat).
STV, vol. 20, n° 10, décembre 2008 515
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%