Les adénomes hypophysaires – Pituitary adenomas

Mise au point
Mise au point
La Lettre du Neurologue - Vol. XI - n° 9 - novembre 2007
328
Les adénomes hypophysaires
Pituitary adenomas
●● G. Brassier*
* Service de neurochirurgie, CHU Pontchaillou, Rennes.
RÉSUMÉ
Les tumeurs hypophysaires sont essentiellement repré-
sentées par les adénomes hypophysaires, regroupant des
entités très différentes, tant par leur caractère sécrétoire
ou non que par leur taille et, surtout, leur agressivité, pour
laquelle il n’existe pas encore de marqueur histologique
fiable. La chirurgie garde une place de choix dans leur
prise en charge, à laquelle participent des traitements
médicaux tenant compte de leur caractère sécrétoire ou
non, mais aussi éventuellement la radiothérapie, en cas
de tumeur agressive.
Mots-clés : Tumeurs hypophysaires – Adénomes hypophy-
saires – Diagnostic – Traitement.
▶
intracrâniennes et sont découvertes le plus souvent entre 35 et
65 ans ; elles sont à peine plus nombreuses chez la femme (53 %),
contrairement à une donnée classique.
L’incidence des adénomes hypophysaires (AH) est de
15,5 nouveaux cas par million d’habitants et par an, sans compter
les découvertes fortuites (ou “incidentalomes”) – 10 % à 40 % –
sur des IRM eff ectuées pour d’autres pathologies. Bénins, les AH
se diff érencient néanmoins par la présence ou non de caracté-
ristiques d’agressivité, hormonale, radiologique, voire histolo-
POINTS FORTS
Tumeurs fréquentes (retrouvées dans environ 10 % des
études autopsiques), les adénomes hypophysaires (AH) sont
comparativement rarement symptomatiques.
Les AH diff èrent par leur éventuel caractère fonctionnel
(sécrétoire) et leur éventuel retentissement sur la glande saine,
leur volume et surtout leur caractère agressif ou non (facteur
pronostique).
Les facteurs d’agressivité sont cliniques, biologiques et
surtout radiologiques (lésion “enclose” ou “invasive”), malheu-
reusement non encore histologiques.
Le traitement des microprolactinomes et des macroprolacti-
nomes enclos est médical ou chirurgical, fruit d’une discussion
ouverte avec la patiente.
Le traitement des macroprolactinomes envahissants est
presque exclusivement médical (agonistes dopaminergiques),
faisant rarement appel à la radiothérapie.
Le traitement de l’acromégalie est toujours chirurgical,
souvent en association à un analogue de la somatostatine
au long cours, parfois à la radiothérapie.
Le traitement de la maladie de Cushing est toujours chirur-
gical (rémission, c’est-à-dire insuffi sance corticotrope post-
opératoire : 80 % des cas).
Les macroadénomes gonadotropes ou non fonctionnels
sont souvent révélés par des troubles visuels inquiétants,
imposant rapidement une chirurgie ; un reliquat tumoral,
notamment intracaverneux (20 %), ne semble pas imposer
une radiothérapie dans l’immédiat.
La découverte d’un incidentalome hypophysaire sur une
IRM débouche rarement sur une chirurgie en l’absence de
retentissement et sous couvert d’une surveillance.
La chirurgie des adénomes hypophysaires se fait à l’heure
actuelle presque exclusivement par voie trans-sphénoïdale.
▶
▶
▶
▶
▶
▶
▶
▶
▶
▶
▶
L
es tumeurs hypophysaires sont fréquentes, dominées par
les adénomes hypophysaires et retrouvées dans les études
autopsiques chez 10 % de la population (8 à 27 % selon
les études) [1, 2], mais la proportion de tumeurs “symptoma-
tiques” apparaît comparativement rare (prévalence autour de
0,02 à 0,05 %). Elles représentent 10 % de l’ensemble des tumeurs
SUMMARY
Pituitary tumors are predominantly adenomas, occuring in
up to 10% of patients. The vast majority of them are benign,
and many are nonfunctional. Functional adenomas mainly
produce prolactin, growth hormone (GH) or adrenocortico-
tropic hormone (ACTH), and can cause a wide spectrum of
diseases and signifi cant morbidity. Although transsphenoidal
surgery remains the most important and recommended form
of treatment, medical therapies are of great interest, even
radiotherapy, because of their effi cacy and also in aggressive
adenomas which represent about 40%. Unfortunately there
is no valid proliferative parameter histologically.
Keywords: Pituitary tumors – Pituitary adenomas –
Diagnosis – Treatment.
▶

Mise au point
Mise au point
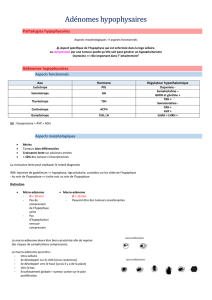
Figure 1.
Coupe coronale IRM en T1 avec injection de contraste.
Microadénome hypophysaire à prolactine, paramédian droit,
apparaissant en isosignal par comparaison avec l’antéhypophyse
et la tige pituitaire en hypersignal.
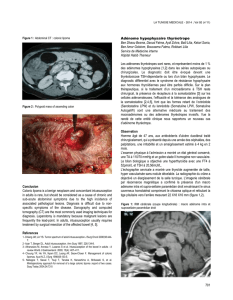
Figure 2.
Coupe coronale IRM en T1 avec injection de contraste.
Macroadénome hypophysaire envahissant le sinus caverneux
droit. Noter que la prise de contraste par l’adénome est moindre
que celle de l’hypophyse et de la tige pituitaire, complètement
refoulées vers la gauche.
La Lettre du Neurologue - Vol. XI - n° 9 - novembre 2007
329
gique, rendant compte d’un taux de récidive de 10 à 35 % entre
4 et 20 ans ; 40 % des adénomes sont “invasifs” et d’évolution
rapide, s’opposant aux autres adénomes dits “enclos”, bien limités
radiologiquement, d’évolution lente et de bon pronostic. À cette
distinction est corrélé un pronostic complètement diff érent,
sachant qu’il n’existe à l’heure actuelle aucun marqueur pronos-
tique histologique formel. La classifi cation des AH repose en
particulier sur leur caractère fonctionnel ou non fonctionnel
(c’est-à-dire sécrétant ou non), les études immuno-histochi-
miques distinguant essentiellement les adénomes à prolactine
ou prolactinomes (40 %), les adénomes à GH ou somatotropes
(16 %), les adénomes corticotropes de la maladie de Cushing
(12 %), les adénomes gonadotropes (FSH et/ou LH) [entre
5 % et 15 %] n’étant souvent que partiellement fonctionnels
et de ce fait intégrés aux adénomes non fonctionnels, dont la
proportion oscille ainsi entre 15 % et 25 %.
TABLEAU CLINIQUE
Cliniquement, les AH s’expriment sous la forme de trois
syndromes (isolés ou associés) : les syndromes d’hypersécré-
tion et/ou d’insuffi sance hormonale, le syndrome tumoral. Le
caractère fonctionnel ou non de l’adénome se traduit le cas
échéant par des signes d’hypersécrétion hormonale, habituel-
lement unique (prolactine, GH ou ACTH, exceptionnellement
TSH) ; une hyperprolactinémie n’est cependant pas toujours
en relation avec un prolactinome, car il existe des élévations,
néanmoins modérées, liées à la compression de la tige pituitaire
(hyperprolactinémie fonctionnelle par “déconnexion hypotha-
lamo-hypophysaire” avec désinhibition des eff ets de la dopamine
hypothalamique sur les cellules lactotropes de l’antéhypophyse).
Le volume lésionnel fait distinguer les microadénomes, d’un
diamètre inférieur à 10 mm (fi gure 1), des macroadénomes,
d’un diamètre supérieur à 10 mm . Les troubles visuels, liés à
l’expansion suprasellaire, sont de diagnostic tardif par le patient
lorsque l’évolution tumorale est lente, et de reconnaissance
diffi cile par l’ophtalmologiste chez un patient âgé souvent atteint
également d’une cataracte, alors qu’ils constituent un élément
prépondérant dans le cadre d’une décision thérapeutique rapide.
Enfi n, il existe des “picoadénomes” (< 3 mm). Un AH est soit
“enclos” (bien limité), soit, à l’inverse, “envahissant” ou “invasif”
(fi gure 2), notamment à l’égard d’un ou des deux sinus caver-
neux. Le caractère invasif constitue un élément pronostique
péjoratif bien que les signes cliniques en soient rares (diplopie,
atteinte trigéminale). En outre, les adénomes fonctionnels inva-
sifs, comparativement aux adénomes enclos, se caractérisent
par un taux d’hypersécrétion hormonale très élevé, témoignant
de l’agressivité tumorale (prolactinomes notamment). Il faut
rechercher de plus une insuffi sance de sécrétion hormonale,

Mise au point
Mise au point
La Lettre du Neurologue - Vol. XI - n° 9 - novembre 2007
330
habituellement incomplète, liée à la compression de la glande
par un macroadénome : elle atteint d’abord la sécrétion gona-
dotrope et est de ce fait fréquemment ignorée. L’insuffi sance
corticotrope puis thyréotrope est tardive, s’exprimant par une
asthénie, méconnue ou négligée ; il n’est pas rare qu’une insuffi -
sance corticotrope se manifeste ou se décompense à l’occasion
d’un autre événement (intervention chirurgicale pour une autre
pathologie, infection). Enfi n, l’atteinte posthypophysaire (diabète
insipide) n’existe que dans les situations aiguës (hémorragie au
sein d’un macroadénome). Une hémorragie intratumorale est
exceptionnelle ; elle peut se traduire seulement par quelques
céphalées (microadénome à prolactine) ou, à l’inverse, par une
situation dramatique s’il s’agit d’un macroadénome (troubles
visuels, céphalées, paralysie oculo-motrice, syndrome méningé,
insuffi sance surrénale aiguë, voire coma). L’hémorragie peut être
soit spontanée, soit favorisée par un traitement anticoagulant
ou antiagrégant plaquettaire prescrit pour une autre patho-
logie. La nécrose intratumorale, habituellement partielle, est
paradoxalement souvent asymptomatique : elle peut s’observer
spontanément, notamment dans les adénomes gonadotropes
ou les prolactinomes, parfois favorisée dans ce dernier cas par
un traitement médical par agoniste dopaminergique.
En IRM (3), il existe dans les AH fonctionnels (prolactinome
surtout) une bonne corrélation entre la taille de l’adénome et le
taux d’hypersécrétion hormonale. Ainsi, un taux de prolactine
supérieur à 200 ng/ml (normale < 25 ng/ml chez la femme non
ménopausée) doit faire craindre une tendance envahissante à
l’égard du sinus caverneux avoisinant. Les AH se développent
le plus souvent à partir d’un aileron latéral de la glande, refou-
lant progressivement la glande hypophysaire saine puis la tige
pituitaire vers l’autre côté ; cela explique l’asymétrie des troubles
visuels dans les expansions suprasellaires. Les microadénomes
apparaissent habituellement en hyposignal T1 et en hypersi-
gnal T2, et, contrairement à la glande hypophysaire et à la tige
pituitaire, ne prennent pas le contraste. Les macroadénomes,
pour leur part, prennent le contraste lorsqu’ils atteignent le
chiasma optique ou envahissent un sinus caverneux, mais dans
tous les cas ce rehaussement est à l’inverse nettement moindre
que celui de la glande saine (parfois réduite à une fi ne lamelle
refoulée latéralement) et de la tige pituitaire (fi gure 2). Cette
diff érenciation entre la lésion et la glande ainsi que la situation
latéralisée de l’AH représentent des arguments essentiels dans
l’affi rmation de la nature adénomateuse de la lésion hypophy-
saire, par opposition avec les autres tumeurs hypophysaires.
Les expansions et l’éventuel caractère envahissant d’un macro-
adénome doivent être appréciés : la problématique dominante
est bien sûr l’affi rmation d’un envahissement possible du sinus
caverneux, uni- ou bilatéralement, laquelle s’appuie notamment
sur les critères proposés par J.P. Cottier et al. (4) [pourcentage
de la circonférence de l’artère carotide interne intracaverneuse
entouré par l’adénome : envahissement certain si ce taux atteint
au moins 67 %, absence certaine d’envahissement s’il est inférieur
à 25 % ou si la tumeur ne dépasse pas la ligne intercarotidienne,
ligne joignant le milieu de la carotide intracaverneuse et celui
de la carotide supraclinoïdienne].
En défi nitive, et à ce stade, le bilan permet le plus souvent d’af-
fi rmer le diagnostic d’AH, de préciser son caractère fonctionnel
ou non, d’apprécier son retentissement clinique et hormonal
ainsi que son aspect agressif potentiel. La discussion concerne
dès lors le choix thérapeutique.
QUE FAIRE FACE À UN PROLACTINOME ?
Cinq fois plus fréquents chez la femme que chez l’homme, les
prolactinomes s’expriment habituellement par une aménorrhée
secondaire et une infertilité, dépistées à l’arrêt d’une contra-
ception orale lors d’un désir de grossesse. Paradoxalement, la
galactorrhée est inconstante (50 % des cas) ; les céphalées sont
fréquentes (40 %) et indépendantes du volume tumoral et du
taux de la prolactinémie, de même que les troubles sexuels
(baisse de la libido, dyspareunie). Une femme sur 5 signale une
prise de poids pouvant atteindre 5 à 8 kg sur 2 ans, délai moyen
de diagnostic. Un seul dosage de la prolactine est généralement
insuffi sant pour affi rmer l’existence d’un microprolactinome,
même si l’IRM révèle une image évocatrice : en eff et, les causes
d’hyperprolactinémie fonctionnelle non liée à un microprolacti-
nome sont nombreuses (neuroleptiques, antidépresseurs, etc.),
ce qui, ajouté à la fréquence des incidentalomes hypophysaires,
peut faire porter à tort le diagnostic d’AH à prolactine, alors
qu’il s’agit d’une coïncidence fortuite. Aussi, il s’avère plus
prudent de réaliser un bilan hormonal comportant de surcroît
un test dynamique (test au TRH) afi n d’évaluer la réponse de
la prolactine, qui se trouve multipliée par 3 ou 4 lorsqu’il s’agit
d’une hyperprolactinémie fonctionnelle (rarement très élevée
en base) ou qui, à l’inverse, s’élève modérément s’il s’agit d’un
prolactinome (“autonome”). En présence d’un microprolac-
tinome (plus d’un cas sur deux) avéré chez une femme jeune
exprimant un souhait de grossesse, deux attitudes thérapeuti-
ques sont envisageables et doivent être proposées à la patiente :
le traitement médical repose sur les agonistes dopaminergiques,
à savoir bromocriptine (Parlodel
®
) et, surtout, quinagolide
(Norprolac
®
) ou cabergoline (Dostinex
®
). Les eff ets indésirables
(céphalées, nausées, hypotension orthostatique, somnolence),
apparemment plus rares avec la cabergoline, sont d’autant
plus fréquents que la prolactinémie est modérément élevée ;
l’augmentation progressive de la posologie initiale ne permet
pas toujours de les éviter. La prolactinémie se normalise dans
80 à 90 % des cas sous traitement médical. La survenue d’une
grossesse fait conseiller la suspension du traitement, le risque
classique d’augmentation de volume d’un microadénome en
fi n de grossesse se révélant infondé. Le problème dominant
réside dans la nécessité de poursuivre le traitement longtemps,
au moins jusqu’à la ménopause, sinon indéfi niment. En eff et,
les études publiées, notamment celle de A.M. Colao et al. (5),
montrent que l’arrêt de celui-ci au bout de 2 ans s’accompagne
d’une reprise de la symptomatologie dans 30 à 40 % des cas.
L’intervention chirurgicale (6), réalisée par voie trans-sphé-
noïdale (ou rhinoseptale), consiste à aborder la selle turcique,
habituellement par voie endonarinaire plus que sous-labiale,
>>>

Mise au point
Mise au point
La Lettre du Neurologue - Vol. XI - n° 9 - novembre 2007
332
et est conduite sous microscope ou par endoscopie. Sa durée
varie de 45 mn à 1 h 15 en moyenne, l’objectif étant de faire
une adénomectomie sélective en préservant l’hypophyse
saine. Tous adénomes confondus, la mortalité oscille entre
0 et 0,5 %, et la morbidité (insuffi sance hypophysaire partielle,
fi stule de liquide céphalospinal [LCS], méningite) est infé-
rieure à 4 %. Néanmoins, la prise en compte de ces risques
doit légitimement intervenir dans la réfl exion de la patiente
atteinte d’hyperprolactinémie, qui, contrairement aux sujets
atteints d’une acromégalie, d’une maladie de Cushing ou d’un
macroadénome hypophysaire agressif, ne se sent pas “vraiment
malade”, bien que la stérilité soit en pratique mal vécue. Le taux
de guérison postopératoire en matière de microprolactinome
se situe entre 80 et 90 % pour un neurochirurgien habitué à
cette chirurgie, avec un taux de récidive à 5 ans de 20 %, sans
qu’apparaisse toujours d’image probante de récidive sur l’IRM.
À l’heure actuelle, l’orientation thérapeutique varie selon les
endocrinologues. Le plus souvent, le traitement médical est
envisagé en première intention, hormis lorsque la patiente,
après réfl exion, souhaite d’emblée se faire opérer, ce qui n’est
pas rare. La chirurgie est proposée en cas d’intolérance au trai-
tement médical ou de désir d’arrêter un traitement prolongé,
voire lorsque la patiente en prend la décision d’emblée. Une
diffi culté opératoire à distinguer l’adénome de l’hypophyse saine
est avancée par certains (6), lorsque la durée du traitement
médical a été longue.
L’abstention thérapeutique vis-à-vis d’un microprolacti-
nome chez une femme proche de la ménopause fait partie
de la discussion, sous couvert d’une surveillance annuelle.
En matière de macroprolactinome, le choix entre traitement
médical et chirurgie est le même que ceux qui sont exposés
plus haut s’il s’agit d’un adénome bien limité et enclos, l’éven-
tualité de troubles visuels n’étant pas de nature à écarter le
traitement médical compte tenu de l’effi cacité antitumorale
rapide bien qu’incomplète des agonistes dopaminer giques,
a fortiori si l’hyperprolactinémie est très élevée, dépassant
200 ng/ml. Si le macroprolactinome est invasif, notamment
aux dépens du sinus caverneux, la chirurgie n’a plus guère
sa place, car elle est de fait très incomplète et moins effi cace
que le traitement médical. Une éventuelle résistance à celui-ci
pourra en revanche la faire discuter, notamment si la lésion
vient au contact du chiasma optique, la diminution du volume
tumoral permettant la réalisation dans de meilleures conditions
d’une radiothérapie ou d’une radiochirurgie stéréotaxiques.
La fonte d’un macroprolactinome sous traitement médical
peut être responsable d’une fi stule de LCS, dont il convient de
prévenir le patient compte tenu du risque de méningite et de
la nécessité d’intervenir alors chirurgicalement pour assurer
l’étanchéité. Enfi n, l’objectif des traitements en matière de
macroprolactinomes invasifs n’est pas de faire disparaître
la lésion, éventualité exceptionnelle, mais de contrôler les
conséquences tumorales et hormonales. Chez l’homme, les
AH à prolactine sont rares mais agressifs, se traduisant par
des troubles sexuels (impuissance, gynécomastie), des signes
tumoraux et, souvent, un anté hypopituitarisme.
QUE FAIRE FACE À UN ADÉNOME SOMATOTROPE
ADÉNOME À GH ?
L’acromégalie est une maladie extrêmement grave, décrite par
Pierre Marie en 1886. Malgré la dysmorphie caractéristique, le
diagnostic est rarement précoce (le délai moyen est de 7 ans).
Le retentissement viscéral (hypertension artérielle, cardiomyo-
pathie, diabète, augmentation du risque de cancer, notamment
colorectal, incitant à une colonoscopie annuelle même chez les
patients contrôlés) va de pair avec un taux de mortalité presque
4 fois supérieur à celui observé dans la population générale. Les
troubles respiratoires sont toujours présents : ronfl ement (il est
impossible de dormir à côté d’un patient acromégale !), apnées
du sommeil. Les troubles rhumatologiques (syndrome du canal
carpien, souvent bilatéral, arthralgies) sont très fréquents, et
l’hypersudation, notamment nocturne, est très pénible. L’AH en
cause est dans 80 % des cas un macroadénome, et la chirurgie
seule ne permet d’obtenir une rémission (terme admis et plus
prudent que celui de “guérison”) que dans 40 % des cas. Heureu-
sement, les analogues de la somatostatine (substance inhibitrice
de la sécrétion de GH), qu’il s’agisse de l’octréotide (Sandosta-
tine
®
) ou du lanréotide (Somatuline
®
), réduisent la sécrétion
de GH chez 70 % des patients acromégales, tandis que leur eff et
antitumoral est beaucoup plus modeste (diminution au mieux
de 20 % du volume lésionnel chez 30 à 50 % des patients). Ils
sont utilisés par voie intramusculaire (une injection mensuelle,
dont le coût est de 1 200 à 1 600 euros), les eff ets indésirables se
limitant le plus souvent à un épisode de diarrhée (un cinquième
des cas) dans les jours suivant l’injection (7). En préopératoire,
et en l’absence d’urgence visuelle, ils permettent d’améliorer
considérablement l’état général du patient, notamment sur le
plan respiratoire et cardiovasculaire, diminuant en outre l’hyper-
trophie muqueuse et favorisant ainsi de meilleures conditions
anesthésiques, en particulier pour l’intubation. Grâce à l’associa-
tion chirurgie-analogue de la somatostatine, le taux de contrôle
de la maladie est de 75 à 80 %. En cas d’échec seront proposés les
agonistes de la dopamine, le pegvisomant (Somavert
®
), qui est
un antagoniste du récepteur de l’hormone de croissance, voire
une radiothérapie ou une radiochirurgie stéréotaxiques.
QUE FAIRE FACE À UN ADÉNOME CORTICOTROPE ?
La maladie de Cushing correspond à un hypercorticisme lié à un
AH corticotrope ; elle est spontanément mortelle. Sa traduction
clinique est riche, comportant des modifi cations esthétiques
péniblement ressenties (obésité facio-tronculaire contrastant
avec des membres inférieurs grêles et amyotrophiques respon-
sable de troubles de la marche, érythrose faciale souvent initia-
lement attribuée à tort à un œnolisme chronique, hypertrichose,
vergetures pourpres abdominales), un retentissement viscéral
sévère (hypertension artérielle, fragilité cutanée et capillaire
responsable de diffi cultés de cicatrisation et d’ecchymoses au
moindre choc, diabète, ostéoporose avec parfois fractures spon-
tanées, phlébites et embolies pulmonaires) et un syndrome
>>>

Mise au point
Mise au point
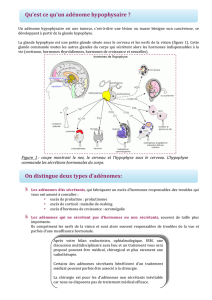
Figure 3.
Coupe coronale IRM en T1 avec injection de contraste.
Maladie de Cushing : picoadénome intra- et centro-hypophysaire,
apparaissant en isosignal par comparaison avec l’antéhypophyse
prenant le contraste (hypersignal).
La Lettre du Neurologue - Vol. XI - n° 9 - novembre 2007
333
dépressif. Une fois l’hypothèse d’un hypercorticisme d’origine
médicamenteuse éliminée (ce qui est chose aisée), la diffi culté va
résider dans l’affi rmation de l’origine hypophysaire de la maladie,
en écartant en outre un hypercorticisme paranéoplasique par
sécrétion ectopique d’ACTH (tumeurs carcinoïdes, notamment
du grêle, carcinomes broncho-pulmonaires). Les explorations
hormonales ciblées (élévation du cortisol libre urinaire, hyper-
cortisolisme avec perte du rythme nycthéméral, absence de frei-
nage lors du test à la dexaméthazone “minute” ou faible, test de
freinage fort, dosage d’ACTH, tests à la métopirone et au CRH)
seront des éléments d’orientation successifs essentiels, l’IRM
mettant en évidence le plus souvent un microadénome, voire
un picoadénome intrahypophysaire (fi gure 3), l’ensemble repré-
sentant plus de 90 % des adénomes corticotropes. La chirurgie
par voie trans-sphénoïdale représente le traitement de choix
de la maladie de Cushing, ses objectifs étant de confi rmer la
présence d’un microadénome, souvent intrahypophysaire, et
de réaliser son exérèse, en y associant la résection d’une fi ne
collerette de l’antéhypophyse immédiatement adjacente, compte
tenu de la fréquente tendance de ces adénomes à être mal limités
et de la nécessité pour le neurochirurgien de “tout faire” pour
obtenir le contrôle de la maladie. Les conditions opératoires
sont souvent délicates (lésion microscopique, fragilité vascu-
laire avec tendance hémorragique, hypertension artérielle labile
d’équilibration diffi cile) et rendent compte sur un tel terrain
d’un taux de complications postopératoires plus élevé que dans
les autres AH. La chirurgie permet d’obtenir une rémission,
terme là encore plus approprié que celui de “guérison”, dans
70 à 80 % des cas (8, 9). En cas de non-contrôle de la maladie
ou encore de lésion non visible en IRM ou durant l’intervention
neurochirurgicale (10 à 12 % des patients), d’autres thérapeu-
tiques sont envisagées (hypophysectomie partielle ou totale,
surrénalectomie “chimique”, par kétoconazole [Nizoral
®
], ou
chirurgicale, par cœliochirurgie, radiothérapie ou radiochirurgie
stéréotaxiques). Si l’intervention neurochirurgicale est un succès,
il existe en postopératoire, au moins pendant 6 mois et parfois
de façon défi nitive, une insuffi sance corticotrope majeure qui
impose une substitution par hydrocortisone ; le patient doit
alors être formé à doubler, voire tripler, la posologie de celle-ci
pendant plusieurs jours en cas d’événement intercurrent telles
une intervention chirurgicale, une infection, etc. À distance, le
taux de récidive est évalué à 9 à 25 %.
QUE FAIRE FACE À UN ADÉNOME GONADOTROPE
OU NON FONCTIONNEL ?
Le plus souvent, il s’agit d’un macroadénome avec troubles
visuels longtemps négligés amenant au diagnostic, chez un
patient de plus de 50 ans, sans prédominance de sexe. L’inter-
vention chirurgicale par voie trans-sphénoïdale est indispen-
sable et l’âge éventuellement avancé du patient ne représente
nullement une contre-indication opératoire. Compte tenu du
volume tumoral, l’insuffi sance hormonale n’est pas rare ; elle
peut être régressive au décours de la chirurgie, contrairement
aux données classiques (6). Dans notre expérience, le suivi IRM
postopératoire révèle la présence d’un résidu tumoral dans 22,5 %
des cas. Compte tenu de l’absence de menace de ce résidu, de
l’incertitude de son caractère évolutif et de la possibilité d’assurer
un suivi fi able avec une IRM annuelle, nous avions décidé il y a
quelques années, et de façon prospective, de ne pas proposer de
radiothérapie systématique dans cette éventualité. Avec un suivi
moyen de 8,7 ans chez 66 patients opérés, le taux de récidive est
de 10,6 %, et l’évolution d’un résidu noté en postopératoire s’ob-
serve dans un tiers des cas seulement, et ce dans un délai moyen
de 4 ans. Ainsi, la radiothérapie ne s’impose pas lorsque persiste
un résidu sur les IRM postopératoires dans de tels adénomes.
D’autre part, si une évolutivité lésionnelle se produit – celle-ci
étant toujours lente et progressive –, une nouvelle chirurgie doit
être discutée au même titre qu’une radiothérapie.
QUE FAIRE FACE À LA DÉCOUVERTE
D’UN “INCIDENTALOME” HYPOPHYSAIRE
SUR UNE IRM? (10)
Si le volume lésionnel est notable, avec déjà soulèvement du
chiasma optique, il convient de réaliser un examen ophtal-
mologique mais aussi un bilan hormonal. Si les résultats de
cette double enquête se révèlent normaux, la discussion avec
 6
6
1
/
6
100%