Seconde EVALUATION N°1 (1h) Partie A : Nécessité de la chimie

Nom, Prénom, Classe : …………………………………………………
Seconde
EVALUATION N°1 (1h)
Toutes les réponses doivent être rédigées et justifiées !!
Partie A : Nécessité de la chimie de synthèse
Partie B : Analyse de deux médicaments contenant de l’aspirine
Partie C : Synthèse de l’aspirine
Partie D : Séparation de l’aspirine
Partie E : Indentification de l’aspirine
Chaque partie est indépendante des autres.
Partie A : Nécessité de la chimie de synthèse (2pts)
Comprendre l’histoire de l’aspirine nous oblige à remonter jusqu’à l’antiquité. Hippocrate (460-377 av J.C),
médecin grec, prescrivait à ses patients des tisanes à base d’écorce de saule pour lutter contre la fièvre ou les maux de
tête. Le traitement d’un saule conduit à la fabrication d’environ 2,3 kg d’aspirine.
En 1859, les chimistes ont pu synthétiser l’acide salicylique en laboratoire et le commercialiser.
Plus tard, les effets secondaires de l’acide salicylique conduisirent les chimistes à modifier sa formule tout en gardant
ses propriétés médicinales. C’est ainsi qu’en 1897 l’allemand Fritz Hoffmann synthétisa pour la première fois l’acide
acétylsalicylique, principe actif de l’aspirine. Aujourd’hui, la consommation mondiale (4560 kg par heure) de l’aspirine
en fait l’une des plus importantes.
1/ Combien de saules faudrait-il abattre par heure pour satisfaire la demande mondiale ?
2/ A l’aide des données et de vos connaissances, rédiger un petit paragraphe (maximum 5 lignes) sur la nécessité de
synthétiser industriellement l’acide salicylique.
Partie B : Analyse de deux médicaments contenant de l’aspirine (2,5pts)
Document 1 : Informations relevées dans les notices de médicaments contenant de l’aspirine
ASPIRINE DU RHONE 500 mg
La substance active est :
Acide acétylsalicylique…………. 500,00 mg pour un comprimé.
Les autres composants sont :
Amidon de maïs, poudre de cellulose granulée.
Ce médicament est un antalgique (il calme la douleur) et un
antipyrétique (il fait baisser la fièvre).
Mode et voie d’administration
Voie orale.
Les comprimés sont à avaler tels quels avec une boisson
(par exemple eau, lait, jus de fruit), de préférence au cours
des repas.
NE PRENEZ JAMAIS ASPIRINE DU RHONE 500 mg, comprimé,
dans les cas suivants :
· allergie à l’aspirine,
· ulcère de l’estomac ou du duodénum en évolution,
·…
ASPÉGIC 1000 mg
Composition :
Acétylsalicylate de DL-Lysine…… 1800 mg (quantité
correspondante en acide acétylsalicylique 1000mg) pour un
sachet de 2046 mg.
Excipients : glycine, arôme mandarine (contient du lactose),
glycyrrhizate d’ammonium.
Ce médicament est indiqué en cas de douleur et/ou fièvre…
Mode et voie d’administration
Voie orale.
Verser le contenu d’un sachet dans un verre puis ajouter une
petite quantité de boisson (par exemple au, lait, jus de fruit).
Dans quels cas ne pas utiliser ce médicament ?
· allergie à l’aspirine,
· ulcère de l’estomac ou du duodénum en évolution,
·…

Document 2 : Ne pas dépasser la dose prescrite !
Banalisée à outrance, d’aucuns jureraient de la complète innocuité d’un
produit aussi courant que l’aspirine ! Pensez donc, toute la famille en
prend ! A haute dose, pourtant l’aspirine est tout simplement
parfaitement mortelle ! Dix grammes d’aspirine, soit une dizaine de
comprimés par jour, peuvent tuer un adulte. La prudence doit être
absolue chez l’enfant et le nourrisson et les doses usuelles strictement
respectées !
L’expression familière : « NE PAS DEPASSER LA DOSE PRESCRITE » prend
véritablement tout son sens et l’aspirine n’est, en aucun cas, le bon ami
à qui on peut confier sa santé les yeux fermés !
Pour l’acide acétyle salicylique, ne jamais dépasser la dose maximale recommandée : 3 g d'aspirine par jour (2 g
maximum chez le sujet âgé).
3/ Quelle est l’espèce ayant une efficacité thérapeutique dans l’Aspégic? Quel nom général lui donne-t-on ?
4/ Citer un excipient de l’aspirine du Rhône.
5/ M. Condriaque a un gros rhume qui lui cause des maux de tête. Sans consulter son médecin, il décide de se soigner
seul. Il prend en une journée 2 sachets d’Aspégic contre ses maux de tête et 3 comprimés d’aspirine du Rhône pour
soulager son rhume. Risque-t-il une surdose (ou overdose) médicamenteuse ? Argumentez.
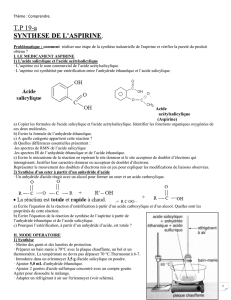
Partie C : Synthèse de l’aspirine (7pts)
L’aspirine C9H8O4(s) est obtenue en chauffant à reflux pendant 20 minutes, avec un réfrigérant à eau, de l’acide
salicylique C7H6O3(s) et de l’anhydride éthanoïque C4H6O3(l) en excès. De l’acide éthanoïque C2H4O2(l) se forme également
lors de cette synthèse.
6/ Dans quel but chauffe-t-on à reflux ?
7/ Choisissez, parmi la liste suivante, la verrerie et le matériel nécessaire pour cette manipulation: ballon, erlenmeyer,
bécher, tubes à essais, réfrigérant à boule, réfrigérant droit, ampoule à décanter, chauffe ballon, balance, pipette,
éprouvette graduée, entonnoir, spatule, papier chromatographie, crayon, cure-dents, règle, boîte de pétri, support
élévateur, coupelle de pesée.
8/ Quels sont les réactifs et les produits de cette réaction ?
9/ Quelle précautions doit-on prendre pour prélever les réactifs de cette synthèse ?
10/ Traduire la transformation chimique par une équation littérale puis par l’équation de la transformation.
11/ Sachant que la densité de l’anhydride éthanoïque est de : dae = 1,082, déterminer la masse volumique de
l’anhydride éthanoïque.
12/ Lors d’un protocole expérimental il est demandé de prélever mae=15,1g d’anhydride éthanoïque. Mais on ne dispose
que d’une éprouvette graduée en mL et pas de balance. Quel volume d’anhydride éthanoïque Vae doit-on mesurer ?
Document 3 : caractéristiques chimiques de quelques espèces chimiques
Produit
Aspirine
Acide salicylique
Anhydride
éthanoïque
Acide éthanoïque
Température de
changement d’état
135°C
159°C
-73°C
16,64°C
Solubilité
2g.L-1 à 20°C
70g.L-1 à 100°C
1,8 g/L à 20°C,
66,6 g/L à 100°C
Réagit violemment
avec l’eau pour
donner de l’acide
éthanoïque
Grande dans l’eau
Pictogramme de
sécurité

Partie D : Séparation de l’aspirine (3,5pts)
Après réaction, on ajoute de l’eau très froide dans le mélange réactionnel et on observe la formation de cristaux blancs
d’aspirine. Une filtration du mélange hétérogène obtenu est réalisée.
13/ En vous aidant du document 3, expliquer pourquoi on ajoute de l’eau très froide (deux raisons).
14/ Pour recueillir les cristaux, on utilise une méthode plus efficace que la filtration par gravitation. De quelle méthode
s’agit-il ? Faire un schéma.
Partie E : Indentification de l’aspirine (5pts)
Document 4 : Plus d'un million de sachets d'aspirine de contrefaçon saisis par les douanes du Havre !
Le 27/05/2013.
Pierre Moscovici, ministre de l’Économie et des Finances, Nicole Bricq, ministre du Commerce extérieur et
Bernard Cazeneuve, ministre délégué chargé du Budget, ont félicité les enquêteurs de la direction des opérations
douanières du Havre, qui ont saisi 1,2 million de sachets d'aspirine de contrefaçon le 17 mai dernier. Les médicaments
étaient dissimulés dans un chargement de thé en provenance de Chine.
Les analyses du laboratoire des douanes ont confirmé les premières conclusions du titulaire de droits sur le caractère
contrefaisant des marchandises interceptées. Aucun principe actif de l'aspirine n'a été décelé sur les échantillons, la
poudre contenue dans les sachets étant essentiellement composée de glucose.
P.J. - ©2013 www.boursier.co.
Données :
Allure du chromatogramme du contenu des sachets saisis
Dépôt 1 : solution du contenu du sachet
Dépôt 2 : solution d’acide salicylique
Dépôt 3 : solution d’acide acétylsalicylique
Ce chromatogramme a été révélé à l’aide d’une lampe UV.
15/ Décrire le protocole expérimental permettant d’obtenir le chromatogramme fourni.
16/ À l’aide des documents joints, des données et de vos connaissances, rédiger un paragraphe expliquant comment les
experts scientifiques du laboratoire des douanes ont pu confirmer que les sachets d’aspirine saisis par les douaniers du
Havre étaient des contrefaçons.
17/ Quelle autre méthode de caractérisation plus rapide auraient-ils pu utiliser ?
Bon travail !
Ligne de front
Ligne de dépôts

CORRECTION :
1/ Nsaule = 4560 / 2,3 = 2,0.103 saules. (1)
2/ La nécessité de synthétiser industriellement l’acide salicylique peut s’expliquer par différents facteurs. Nous sommes
de plus nombreux sur Terre et déjà, il serait nécessaire d’abattre 2000 saules par heure pour subvenir aux besoins
actuels. Et qu’adviendrait-il en cas d’intempérie de type cyclone, inondation, tremblement de terre ? La production
industrielle permet donc de s’affranchir des aléas climatiques, d’approvisionner le monde entier, de préserver les
ressources naturelles, de fabriquer à moindre coût (la main d’œuvre pour s’occuper de ces milliers de saules serait
considérable). Elle a enfin l’avantage de produire de nouvelles espèces présentant moins d’effets secondaire sur
l’homme. (1,5)
3/ Dans l’Aspégic, l’espèce ayant une efficacité thérapeutique est l’acétylsalicylate de DL-Lysine. On appelle ce type de
molécule des principes actifs. (0.5+0.5)
4/ L’amidon de maïs est un excipient de l’aspirine du Rhône. (0.5)
5/ Déterminons quelle est la dose de principe actif ingurgité par M. Condriaque :
maspirine = 2 * maspirine sachet aspégic + 3 * m aspirine rhone = 2* 1000.10-3 + 3* 500,00.10-3 = 3,500g d’aspirine
Il risque une surdose (ou overdose) médicamenteuse puisque le document 2 stipule que la dose maximale
recommandée est de 3g d’aspirine par jour. (1.5)
6/ On chauffe pour accélérer la réaction mais sans perdre de réactifs grâce au réfrigérant qui condense les vapeurs qui
peuvent apparaître. (0.5+0.5)
7/ La verrerie et le matériel nécessaire à un montage à reflux: support élévateur, chauffe ballon, ballon, réfrigérant à
boule. (1)
8/ Les réactifs sont : Acide salicylique + anhydride acétique et les produits : acide acétique + aspirine (0.5+0.5)
9/ Les réactifs étant inflammables et toxiques et dangereux pour l’environnement. Il faut donc porter des gants, lunette,
blouse, manipuler sous hôte et loin de toute source de chaleur et ne rien verser à l’évier. (1)
10/ Bilan littéral : Acide salicylique + anhydride acétique acide acétique + aspirine (1)
Equation bilan équilibrée : C7H6O3(s) + C4H6O3(l) C9H8O4(s) + C2H4O2(l) (1)
11/ daa = aa / eau donc aa = daa * eau AN : aa = 1,082 * 1000 = 1,082.103g.L-1 (1,5)
12/ aa = m aa/ Vaa donc Vaa = m aa/aa AN : Vaa = 15,1 / 1,082.103 = 1,4.10-2 L = 14mL (1,5)
13/ On ajoute de l’eau très froide car d’après le document 4, l’acide acétyle salicylique n’est pas soluble dans l’eau
froide. Des cristaux apparaissent donc lorsqu’on ajoute l’eau froide. On peut ensuite les recueillir par filtration. Par
ailleurs, il est précisé dans l’énoncé que l’anhydride acétique a été introduit en excès. Or il réagit avec l’eau pour donner
de l’acide éthanoïque dont la solubilité est grande dans l’eau. Donc en ajoutant de l’eau froide, on sépare l’aspirine de
l’anhydride éthanoïque en excès. (1)
14/ Filtration sous vide ou Buchner (0.5) + schéma (1)
15/ Protocole expérimental permettant d’obtenir le chromatogramme fourni :
Préparer la cuve à chromatographie en y plaçant un fond d’éluant. Boucher. Sur la plaque à chromatographie, tracer
une ligne de dépôt et réaliser les 3 dépôts à l’aide d’un micro capillaire. Introduire la plaque dans la cuve. Le solvant
migre le long d’une phase stationnaire (la plaque à chromatographie) entrainant plus ou moins rapidement les espèces
chimiques. Chaque espèce chimique migre à une hauteur différente. (1,5)
3
1
2
Cuve à chromatographie
Front de l’éluant
Plaque à chromatographie
dépot
Ligne de dépot
Solvant

16/ Les experts scientifiques du laboratoire des douanes ont pu confirmer que les sachets d’aspirine saisis par les
douaniers du Havre étaient des contrefaçons en analysant la chromatographie obtenue. En effet, dans les sachets saisis,
il n’y a pas un corps pur (puisque deux espèces ont migré à des hauteurs différentes) mais un mélange ne contenant
pas d’acide acétylsalicylique (aucune espèce a migré à la même hauteur que l’acide acétylsalicylique de référence). (1)
17/ L’autre méthode de caractérisation plus rapide est la mesure de la température de fusion : 135°C. Il faut savoir que
la présence d’impuretés dans une espèce abaisse la température de fusion. (0.5)
1
/
5
100%