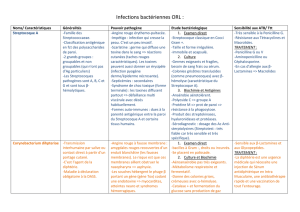
Conduite à tenir lors de l`apparition d`un cas de diphtérie HCSP

Conduite à tenir
lors de l’apparition
d’un
cas de
diphtérie
Collection
Documents


COMMISSION SPECIALISEE MALADIES TRANSMISSIBLES
Conduite à tenir lors de l’apparition
d’un cas de diphtérie
Rapport du groupe de travail
4 mars 2011

Haut Conseil de la santé publique
2

Conduite à tenir lors de l’apparition d’un cas de diphtérie
3
SOMMAIRE
MANDAT 5
COMPOSITION DU GROUPE DE TRAVAIL 6
AVANT-PROPOS 7
INTRODUCTION 9
POINT DES CONNAISSANCES 9
1 - Epidémiologie 9
1.1 - En France 9
1.1.1. - Bactéries porteuses du gène tox (tox+) 9
1.1.2. - Bactéries non porteuses du gène tox (tox-) 11
1.2 - En Europe et dans le monde 12
1.2.1 - Europe centrale et orientale 12
1.2.2 - Europe de l’Ouest 12
1.2.3 - Pays en développement 13
1.2.4 - Amérique du Nord 13
2 - Transmission 13
2.1 - Modes de transmission 13
2.2 - Réservoirs bactériens 14
2.2.1 - Homme 14
2.2.2 - Animal 14
3 - Manifestations cliniques 15
3.1 - Formes ORL 15
3.2 - Formes cutanées 15
3.3 - Complications toxiniques 16
3.3.1 - Neurologiques 16
3.3.2 - Myocardiques 16
3.4 - Autres formes cliniques 16
4 - Diagnostic 17
4.1 - Isolement 17
4.2 - Identification 17
4.3 - Recherche de la toxinogénèse 18
4.4 - Antibiogramme 18
4.5 - Techniques de typage des bactéries 18
4.6 - Sérologie 18
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
1
/
56
100%