Biologie cellulaire

UE: Biologie cellulaire
Cours magistraux
(CM)
Travaux dirigés
(TD)
Travaux pratiques
(TP)
Licence 1 - Année 2016- 2017
Semestre 1
Responsable : Hanna Hlawaty
hanna.hlawaty@univ-paris13.fr

Biologie cellulaire
Travaux dirigés (TD)
6 TD au total
1TD = 2h
contrôle continu (CC) sous forme de TD noté
•exercices
•QCM
•questions simples des cours
•mots croisées/définitions
•texte à trou

Travaux pratiques (TP)
Biologie cellulaire
RESPECT
professeurs + collègues + matériel
travail en équipe
travail en blouse
prévenir en cas de retard dû à la
SNCF / RATP
absence sans justificatif = 0/20
1. Etude de l’ovogenèse
2. Etude de l’osmose
3. Extraction d’ADN
•RETARD
•changement de groupe
•cheveux non attachés
•téléphone portable
•casquette
•talons
•nouriture
Compte-rendu
TP=3h
3 TP au total

Cours
magistraux
(CM)
Travaux dirigés
(TD)
Travaux pratiques
(TP)
UE: Biologie cellulaire
Licence 1 - Année 2016- 2017

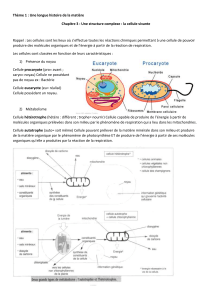
Cours 1 : Introduction à la biologie cellulaire (Hanna Hlawaty)
Cours 2 : Le cytosquelette (Hanna Hlawaty)
Cours 3 : Glucides, lipides, protéines I (Nathalie Charnaux)
Cours 4: Glucides, lipides, protéines I (Nathalie Charnaux)
Cours 5: Compartiments membranaires et trafic intracellulaire I (Hanna Hlawaty)
Cours 6 :Compartiments membranaires et trafic intracellulaire Ii (Hanna Hlawaty)
TD1: réviser les cours !!!
Cours 7 :La meïose, La spermatogenèse (Anne Arlot)
Cours 8 : L'ovogenèse, Fécondation (Anne Arlot)
TD2: réviser les cours !!!
Cours 9 :Membranes biologiques (Nathalie Charnaux)
Cours 10 :Membrane et antigène (Nathalie Charnaux)
Cours 11 : Cycle cellulaire et Mitose (Anne Denys)
TD3: réviser les cours !!!
Cours 12 : Structure de l’ADN, Chromosome, La chromatine, La réplication I (Anne Denys)
Cours 13 : Structure de l’ADN, Chromosome, La chromatine, La réplication II (Anne Denys)
Cours 14 : Problèmes liés à la compartimentation (Anne Denys)
TD4: réviser les cours !!!
Cours 15 :Cytosol - Trafic des acides nucléiques (Anne Denys)
Cours 16 : La traduction, Le noyau - Le nucléole I (Anne Denys)
Cours 17 :Matrice extracellulaire (Nathalie Charnaux)
Cours 18 : La traduction, Le noyau - Le nucléole II (Anne Denys)
TD5: réviser les cours !!!
Cours 19 : La production d’énergie dans la cellule (Anne Denys)
Cours 20 :Communications intercellulaires et Jonctions cellulaires (Nathalie Charnaux)
TD6: réviser les cours !!!
PLAN GENERAL DU COURS DE BIOLOGIE CELLULAIRE
(S1F1)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%