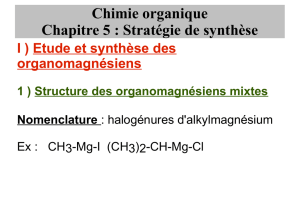
Réactions en chimie organique

1/2
TP 14 Réactions en chimie organique
Commencer par lancer l’expérience du II. puis
pendant le temps de réaction traiter le I.
I. Réaction d’un alcène avec le dibrome:
La réaction d’un alcène (incolore) avec le dibrome (de couleur brun- orange) a pour équation :
CnH2n + Br2 = CnH2nBr2
Chacun des atomes de brome se lient à l’un des deux atomes de carbone de la double liaison.
Soit le limonène C10H16, un alcène de formule topologique :
1) Expérience :
- Verser 1 mL de solution de limonène dans un tube à essais.
- Ajouter quelques gouttes de la solution de dibrome.
- Agiter puis observer.
2) Questions :
a) Ecrire l’équation de la réaction entre l’alcène et le dibrome en utilisant des formules semi-développée. (toutes les
doubles liaisons peuvent être concernées)
b) En utilisant un des trois termes, « addition », « substitution » ou « élimination » décrire la nature de la réaction
étudiée. Entourer les atomes ou les groupes d’atomes qui interviennent dans la transformation.
c) Quelle modification de structure de l’alcène a eu lieu ici ?
d) Cette réaction peut être utilisée pour caractériser un alcène. Pourquoi ?
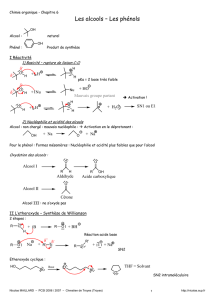
II. Synthèse d’un composé halogéné :
1) Données :
L'action de l'acide chlorhydrique concentré en excès sur le 2-méthylpropan-2-ol permet de préparer un composé halogéné le
2-chloro-2-méthylpropane. Le deuxième produit de cette réaction est de l'eau.
2-méthylpropan-2-ol : Teb = 83°C, densité d = 0,79 très peu soluble dans l’eau.
2-chloro-2-méthylpropane : Teb = 50.7°C, densité d = 0,85 Très peu soluble dans l’eau
Acide chlorhydrique : solution à 37% densité d=1,19 soluble dans l’eau en toutes proportions.
Avant de commencer les manipulations observer les pictogrammes de sécurité ci-dessus. Rechercher les risques que peut
présenter l’utilisation de ces substances chimiques (livre fiche pratique n°6, page B15) et s’organiser en conséquence pour
toutes les manipulations de cette partie.
Commencer les manipulations une fois vos mesures de sécurité présentées au professeur.
2) Protocole expérimental :
a) Synthèse du dérivé halogéné :
- Sous la hotte, introduire 5 mL de 2-méthylpropan-2-ol distribué par le prof puis 15 mL d'acide chlorhydrique
concentré dans un erlenmeyer de 100mL.
- Introduire un barreau magnétique puis le bouchon muni du réfrigérant à air.
- Mettre en marche l'agitateur magnétique et laisser réagir pendant 20 à 25min à température ambiante.
b) Séparation et lavage du dérivé halogéné : Mettre des gants et des lunettes !
- Transvaser le mélange réactionnel dans l’ampoule à décanter.
- Laisser décanter 3min
- Eliminer la phase aqueuse. Récupérer la phase organique dans un bécher.
- Ajouter 30mL d'une solution d'hydrogénocarbonate de sodium (HCO3- + Na+) ceci dans le but d’éliminer l’acide en
excès encore présent.
- Agiter avec une baguette en verre. Lorsque le dégagement gazeux est terminé transvaser le mélange dans l'ampoule à
décanter.
- Agiter, décanter, éliminer la phase aqueuse.
- Recueillir la phase organique dans un bécher propre et sec.
Compétences
expérimentales
du TP12
S’approprier
Réaliser
Valider
Communiquer
Etre
autonome
Partie
concernée
II.1)
I. II. et
III
II.1) et2)
a) c) et d)
Toutes parties
Toutes
parties

2/2
c) Test de reconnaissance du dérivé halogéné :
Test d’un dérivé halogéné pur :
Dans un tube à essai introduire 2ml de solution de nitrate d’argent puis 1 ou 2 gouttes du dérivé halogéné 2-chloro-2-
méthylpropane pur. Agiter. Observer.
Test du produit synthétisé :
- Dans un tube à essai propre et sec, introduire 2ml de solution de nitrate d’argent puis 1 ou 2 gouttes du dérivé
halogéné synthétisé précédemment.
- Agiter. Observer et conclure.
d) Distillation :
Dans le but de vérifier l’identité du produit formé on effectue une distillation
de l’ensemble des phases organiques de la classe recueillies dans un ballon de
250mL (contenant quelques grains de pierre ponce et 50ml de cyclohexane).
Relever la température en tête de colonne indiquée par le thermomètre.
3) Exploitation :
a) Quels sont les rôles:
- du réfrigérant à air ?
- de la solution d’hydrogénocarbonate de sodium ?
b) Justifier la position respective des phases aqueuse et organique dans l’ampoule à décanter lors de la séparation
des phases.
c) Ecrire l’équation de la réaction de synthèse du dérivé halogéné avec des formules semi-développée.
d) En utilisant un des trois termes, « addition », « substitution » ou « élimination » décrire la nature de la réaction
étudiée. Entourer les atomes ou les groupes d’atomes qui interviennent dans la transformation.
e) Annoter le schéma du montage de distillation.
f) Quelle température est indiquée par le thermomètre lors de la distillation ? Au regard de cette valeur conclure
quant au produit formé lors de la synthèse du dérivé halogéné.
4) Complément: reformation de l’alcool
La phénolphtaléine est un indicateur coloré de pH-métrie. En milieu basique pH>8 (contenant majoritairement des ions HO-),
comme la soude, la phénolphtaléine prends une colore rose, et se décolore dans un milieu avec un pH < 8.
a) Dans un tube à essai, introduire 2 ml de soude (Na+ + HO-), quelques gouttes de phénolphtaléine puis 2ml du dérivé
halogéné formé. Agiter 3 à 4 minutes.
b) Noter vos observations. Que sont devenus les ions HO- présent initialement dans la soude ?
c) Ecrire l’équation de la réaction permettant de reformer l’alcool à partir du dérivé halogéné.
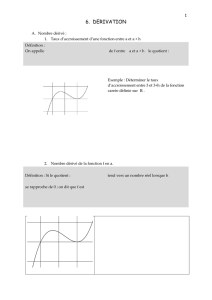
III. Substitution, addition, élimination... Quel type de réactions peut-on associer aux différentes réactions ?
Le cyclohexanol est un alcool produit industriellement chaque année à hauteur de plusieurs s millions de tonnes.
En présence d’acide chlorhydrique (H+ + Cl-), il se forme du chloro-
cyclohexane (réaction a)
En présence d’acide sulfurique (2H+ + SO42-), qui joue le rôle de
catalyseur (accélérateur de réaction), il se forme du cyclohexène
(réaction b), qui peut réagir à son tour avec le dibrome (réaction c).
1) Associer un des qualificatifs présent dans le titre du paragraphe pour
les réactions a, b, et c, en précisant les atomes (ou groupes) ou
molécules dont il est question dans les définitions.
2) Proposer la formule topologique de l’unique produit de la réaction c.
A quel type de réaction correspond donc cette réaction ?
a)
b)
c)
1
/
2
100%