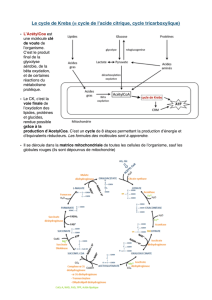
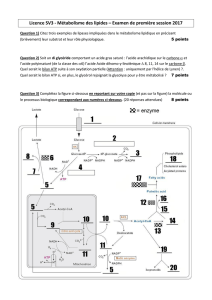
réactions exergoniques

Chapitre 16 : Introduction au métabolisme
1. Métabolisme cellulaire
2. Rappels de thermodynamique
3. Rôle particulier de l’ATP
4. Composés extrêmement riches en énergie
5. Réactions d’oxydoréduction

•Les réactions biochimiques dans la cellule sont à
l’équilibre
•Les organismes vivants ne sont pas à l’équilibre
•Par le métabolisme l’organisme vivant consomme de
l’énergie libre pour assurer différentes fonctions
Métabolisme cellulaire 1

•Pour les êtres phototrophes l’énergie libre est
fournie par le soleil grâce à la photosynthèse (CO2+
H2O --> glucides + O2)
•Les êtres chimiotrophes obtiennent leur énergie
libre en oxydant des composées organiques provenant
d’autres organismes phototrophes.
•L’énergie libre est le plus souvent utilisée pour la
synthèse intermédiaire de composés phosphorylés
riches en énergie tels que l’ATP.
Métabolisme cellulaire 2

Métabolisme cellulaire 3
Biomolécules
Matériaux de
construction
Energie
Travail cellulaire
Aliments Déchets
Anabolisme
(réactions
endergoniques)
Catabolisme
(réactions
exergoniques)
Lumière

Ensemble de réactions enzymatiques se déroulant
à l’intérieur d’une cellule
Voie métabolique : séquence de réactions permettant
la synthèse ou la dégradation d’un composé
Voies cataboliques : voies de dégradation; souvent
productrices d’énergie (glycolyse, cycle de Krebs,
ß oxydation)
Voies anaboliques : voies de biosynthèse
(gluconéogenèse, cycle de Calvin, acides gras etc…)
Métabolisme intermédiaire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%