Nouvelle Calédonie

Les graisses saturées, l'acide lactique, énergie cinétique et
sécurité : bac ST2S Nelle Calédonie 2009
Les graisses saturées proviennent principalement des aliments d'origine animale.
On les retrouve dans le beurre, les sauces ou les collations riches en graisses comme les
patisseries, les chips ..... Au sein du groupe des aliments d'origine végétale, ce sont surtout
I'huile de noix de coco et l'huile de palme qui sont riches en acides gras saturés.
L'acide palmitique est un acide gras qui se trouve dans I'huile de palme, mais aussi dans
toutes les graisses et huiles animales ou végétales (beurre, fromage, lait et
viande). La formule de I'acide palmitique est C15H31COOH.
Donner la définition d'un acide gras saturé.
Il s'agit d'un acide carboxylique : la chaine carbonée, saturée ou insaturée, aliphatique (
non cyclique) , doit compter un grand nombre d'atomes de carbone.
Montrer, d'après la formule, que cet acide gras est saturé.
La chaine carbonée C15H31- compte 15 atomes de carbone : une chaine saturée doit compter
15*2 +1 = 31 atomes d'hydrogène.
L'acide palmitique est donc saturé.
Le triglycéride contenu dans l'huile de palme est la palmitine. On peut synthétiser la palmitine
à partir du glycérol et de l'acide palmitique.
On donne la formule semi-développée du glycérol ;
entourer et nommer les trois groupes caractéristiques.
Quelle est la formule brute du glycérol ?
C3H8O3.
La synthèse de la palmitine est réalisée grâce à un montage à reflux.
Annoter, à l'aide du vocabulaire donné ci-dessous, le schéma du montage à reflux de la
figure.
entrée de l'eau, sortie de l'eau, ballon, chauffe ballon, élévateur, réfrigérant à eau.

On donne la formule de la palmitine.
Entourer et nommer les trois groupes caractéristiques présents.
Pourquoi peut-on dire qu'un triglycéride est un triester ?
Un triglycéride possède trois fonctions ester : c'est un triester.
Recopier, puis compléter l'équation d'estérification du glycérol par l'acide palmitique en
indiquant les formules semi-développées manquantes et en ajustant les nombres
stoechiométriques.

L'acide lactique.
Une bouteille de lait présente dans un réfrigérateur a été ouverte iI y a quelques jours.
Afin de savoir si Ie lait est toujours frais, un chimiste décide de doser I'acide lactique
présent. En effet, un lait est considéré comme frais lorsque la masse d'acide lactique
est inférieure à 1,8 g par litre de lait.
L'acide lactique possède deux des groupes caractéristiques des fonctions organiques
suivantes : aldehyde; alcool; cétone; ester; amine; acide carboxylique.
Sa formule semi-développée est donnée.
Recopier la formule semi-développée de l'acide lactique, entourer puis nommer
les deux groupes caractéristiques présents.
Déterminer la formule brute de I'acide lactique et montrer que sa masse molaire
moléculaire est égale à 90 g/mol.
Données: masses molaires atomiques en g/mol: H: 1 ; C : 12 ; 0 : 16.
C3H6O3 ; M = 3*12 + 6 +3*16 = 90 g/mol.
Pour savoir si Ie lait est frais, Ie chimiste prélève un volume VA = 20,0 mL de lait qu'il
dose par une solution d'hydroxyde de sodium (Na++ HO- ) solution appelée aussi
soude, de concentration CB = 5,0 x 10-2 mol /L..
L'évolution du pH en fonction du volume VB de soude versé est donné ci-dessous.
L'équation de la réaction acido-basique qui a lieu au cours du dosage est la suivante :
Vérifier graphiquement que le volume versé à l'équivalence est VE = 12,0 mL.

Définir l'équivalence acido-basique et montrer qu'à l'équivalence on peut écrire : CA.VA
= CB.VB.
A l'équivalence les réactifs sont en proportions stoechiométriques ; avant l'équivalence,
l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès.
Quantité de matière d'acide lactique : volume fois concentration = VA CA ;
Quantité de matière de soude ajoutée à l'équivalence : VE CB ;
Les nombres stoechiométriques situés devant les réactifs étant identiques : VA CA = VE
CB.
En déduire que la concentration molaire en acide lactique dans le lait est égale à CA =
0,030 mol/L.
CA = VE CB / VA =12,0 *5,0 x 10-2 /20,0 =0,030 mol/L.
En déduire la masse d'acide lactique présente dans le lait. Ce lait est-il frais ? Justifier.
titre massique (g/L) = masse molaire(g/mol) * concentration (mol/L)
90,0 * 0,030 =2,7 g/L.
Cette valeur est supérieure à 1,8 g/L : ce lait n'est pas frais.
Energie cinétique et sécurité routière.
Juste avant de partir passer l'examen du permis de conduire, Sophie se demande quels facteurs
peuvent influencer la distance d'arrêt de son véhicule. Plusieurs idées lui viennent à l'esprit.
La vitesse :
On considère une voiture de masse m = 1800 kg roulant à la vitesse constante V1= 50 km.h-1.
Démontrer que cette vitesse est aussi égale à environ V1= 14 m.s·1.
50 km = 50 000 m ; 1 h = 3600 s
50000 m parcourus en 3600 s soit : 50000 / 3600 ~ 14 m/s.

Calculer l'énergie cinétique Ec1 de la voiture.
50 000 / 3600 = 13,89 m/s
Ec1 = ½ mV12=0,5*1800*13,892 =1,7 105 J.
A présent, cette voiture roule à une vitesse V2= 100 km.h-1.
Calculer l'énergie cinétique Ec2 de la voiture.
100 000 / 3600 = 27,78 m/s
Ec2 = ½ mV22=0,5*1800*27,782 =6,9 105 J.
Calculer Ie rapport Ec2 / Ec1.
Ec2 / Ec1 = 6,9 / 1,7 = 4,0.
A partir du résultat précédent, compléter la phrase suivante :
" Si la vitesse d'une voiture est multipliée par deux alors son énergie cinétique Ec ... "
en choisissant l'une des propositions suivantes :
... ne change pas.
... est multipliée par 2
... est multipliée par 4
... est divisée par 4.
" Si la vitesse d'une voiture est multipliée par deux alors son énergie cinétique Ec est
multipliée par 4.
Les conditions extérieures.
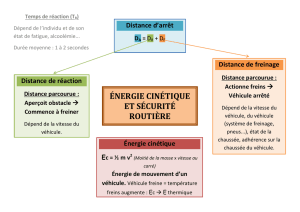
Avant de s'arrêter, un véhicule se déplace sur une distance, appelée distance d'arrêt notée DA.
Cette distance est constituée de deux phases successives :
• Distance de réaction DR : distance parcourue pendant le temps de réaction du conducteur ;
• Distance de freinage DF: distance parcourue par le véhicule entre le moment ou le
conducteur freine et celui ou le véhicule s'arrête.
Donner la relation entre DA, DR, et DF.
DA= DR+ DF.
On rappelle que la distance d'arrêt dépend de différents facteurs comme :
l'alcoolémie du conducteur, la prise de cannabis, l'état des pneus du véhicule, la présence de
verglas sur la route.
Pour chacun des facteurs présentés ci-dessus, préciser s'i1s ont une influence sur la
distance de réaction DR ou sur la distance de freinage DF.
L'alcoolémie du conducteur, la prise de cannabis, influent sur la distance de réaction.
L'état des pneus du véhicule, la présence de verglas sur la route, influent sur la distance
de freinage.
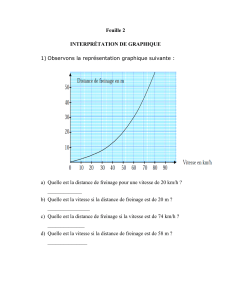
On a représenté graphiquement l'influence de l'alcoolémie sur la distance d'arrêt d'un véhicule
en fonction de la vitesse au moment du freinage.
En vous aidant du graphique, déterminer la distance d'arrêt à 90 km.h-1 pour une
 6
6
1
/
6
100%