Diapositives présentées - Académie Nationale de Pharmacie

Vieillissement Immunitaire : du fondamental à la clinique
Guislaine Carcelain
Département d’Immunologie, Hôpital Pitié-Salpêtrière
CIMI-Paris, UPMC-INSERM U1135
Delphine Sauce
CIMI-Paris, UPMC-INSERM U1135
Académie de Pharmacie, 1er juin 2016, Paris

Quelques estimations pour les années à venir…
Espérance de vie
2016
Qualité de vie & comorbidités
Avec l’âge avancé: susceptibilité et séverité augmentées aux pathologies
infectieuses, cancéreuses, cardiovasculaires, auto-immunes …
Cause: immunosénescence ??
2013 : 841 Millions > 60 ans, 2050 : x3; Europe +++

Partie 1
Le système immunitaire normal
Partie 2
Le système immunitaire sénescent
Partie 3
Conséquences cliniques

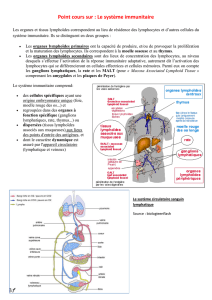
Un système Immunitaire « normal » (1)
LB LT PN Monocytes
macrophages
plaquettes GR
Cellules souches hématopoïétiques
Capacité d’autorenouvellement
Potentiel clonal diversifié
Cellules souches lymphoïdes
Cellules souches myéloïdes
Équilibre cellulaire constant
Répartition
Nombre
Moelle osseuse
LNK
CD4, CD8

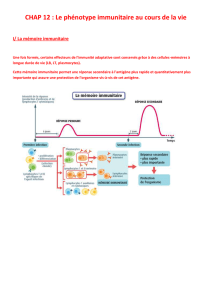
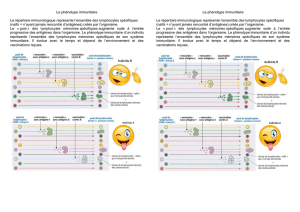
Un système Immunitaire « normal » (2)
Cellules souches lymphoïdes
Différenciation LB Différenciation LT
Lymphocytes B naïfs Lymphocytes T naïfs
Mémoires switchées
Mémoires IgM only
Mémoires CD27-
Mémoires centrales
Mémoires transitionnelles
Mémoires effectrices / terminales
Moelle osseuse Thymus
Antigène
Activation
Organes lymphoïdes secondaires
Organes lymphoïdes primaires
Centres
Germinatifs
1 lymphocyte = 1 récepteur = 1 antigène
Répertoire lymphocytaire
Lymphocytes T et B mémoires / effecteurs
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%