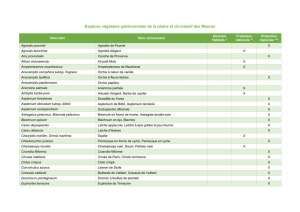
Mise en place d`une méthode de diagnostic agro

UFR SVE
Sciences de la Vie
et de l'Environnement
MST AMVDR
Maîtrise des Sciences et Techniques
Aménagement et Mise en Valeur
Durable des Régions
Mise en place d’une méthode de
diagnostic agro-écologique en zone de
montagne
Application dans la Réserve Naturelle de Nohèdes
(Pyrénées-Orientales)
Toute utilisation ultérieure de ce document devra faire état de ses références :
B
ARATAUD
Julien, 2007 – Mise en place d’une méthode de diagnostic agro-écologique en zone de
montagne – Application dans la Réserve Naturelle de Nohèdes. 50 p. Mémoire MST AMVDR,
Université de Rennes 1.
Responsable de la formation : Daniel Cluzea
u
Julien Barataud
soutenance le 12 Septembre 2007 à Rennes
Promotion : 2005-2007
Structure d'accueil :
Réserve Naturelle de Nohèdes
Correspondante
universitaire :
Anne Bonis
Maître de stage : Sylvain Abdulhak

2
Remerciements
Mes remerciements s’adressent en priorité à toute l’équipe de la Réserve Naturelle qui m’a
chaleureusement accueilli et soutenu durant ces cinq mois en leur compagnie.
Un grand merci à Sylvain pour son encadrement irréprochable et pour son aide précieuse lors
de la phase d’analyse des résultats. Ce mémoire n’aurait certainement pas abouti sans ses
nombreux coups de main… Merci à Tatiana pour ces conseils avisés sur la phytosociologie qui
m’ont fait éviter de nombreux écueils méthodologiques... Merci à Alain de m’avoir soutenu et
d’avoir supporté les piles de références bibliographiques et de plantes à identifier éparpillées dans
les locaux… Merci à Flora pour son soutien et sa bonne humeur contagieuse.
Je remercie aussi Michel, pour son coup de main de dernière minute…
Une pensée également pour Mathieu et Yann qui ont partagé avec moi tous les bons moments
mais aussi les nombreuses difficultés rencontrées au cours de ce stage. L’émulation créée par ce
travail en commun sur une même problématique a beaucoup contribuée à l’aboutissement de ce
mémoire.
Et enfin, merci à toutes les autres personnes rencontrées durant cette escale au fin fond des
Pyrénées, sans qui ce stage n’aurait certainement pas été aussi agréable et enrichissant.

3
Résumé
Une méthode d’étude de la végétation basée sur la phytosociologie a été mise en place dans
une zone pastorale de montagne, au sein de la Réserve Naturelle Nationale de Nohèdes, dans les
Pyrénées-Orientales. L’objectif principal est l’évaluation de l’impact de la gestion pastorale sur les
habitats afin de concilier les enjeux liés aux activités d’élevage et à la diversité écologique. Les
relevés phytosociologiques effectués ont permis non seulement d’évaluer les valeurs pastorales et
écologiques des habitats à l’aide de différents indicateurs, mais également de mettre en évidence
les processus responsables de l’évolution des milieux. Ces connaissances approfondies acquises
sur la végétation et sa dynamique permettent alors de formuler des enjeux et des propositions de
gestion en accord avec les objectifs de conservation patrimoniale du territoire.
Mots-clés : Diagnostic – Phytosociologie – Pratiques pastorales – Indicateur – Gestion
conservatoire
Abstract
A survey method based on phytosociology was performed in a pastoral mountain area, in the
National Reserve of Nohèdes (Pyrénées-Orientales). The main objective, through the pasture
consequence on different habitats, was to conciliate pastoral and ecological exigencies. The use of
several indicators leads to a qualitative evaluation of habitats according to these demands; the
processes accountable for current habitat evolution had been identified.
Results obtained during this study show that deep knowledge of vegetation composition and
dynamics can leads to management prescriptions adapted to high biological interest areas
including traditional human activities.
Keywords: Diagnosis - Phytosociology – Grazing practices – Indicator – Conservation
management

4
Sommaire
Introduction p.6
1. Présentation de la zone d’étude et du contexte agro-pastoral p.8
1.1. Milieu physique p.8
1.1.1. Situation géographique p.8
1.1.2. Géologie p.9
1.1.3. Hydrologie p.10
1.1.4. Climat p.10
1.2. Statuts de protection et d’inventaire p.11
1.3. Contexte écologique p.11
1.3.1. Habitats p.11
1.3.2. Faune et flore p.12
1.4. Contexte agro-pastoral p.12
1.4.1. Historique des pratiques agro-pastorales p.12
1.4.2. Organisation actuelle de l’espace pastoral p.15
2. Matériel et méthodes p.18
2.1. Cartographie des habitats p.18
2.2. Etude phytosociologique p.19
2.2.1. Un peu de vocabulaire phytosociologique p.19
2.2.2. L’échantillonnage des communautés végétales p.20
2.2.2.1. Le choix de la surface du relevé p.20
2.2.2.2. Le relevé phytosociologique p.21
2.2.3. L’échantillonnage des phytocénoses p.22
2.3. Relevés orthoptériques p.23
2.3.1. Choix des stations p.24
2.3.2. Identification et abondance des espèces p.24
2.4. Traitement des données p.24
2.4.1. Base de données p.24
2.4.2. Etude de l’offre fourragère p.25

5
2.4.3. Etude de l’intérêt écologique p.26
2.4.3.1. Espèces végétales patrimoniales p.26
2.4.3.2. Richesse et diversité spécifique des habitats p.26
2.4.3.3. Identification des habitats p.27
2.4.4. Analyse fonctionnelle de la végétation p.27
3. Résultats et analyse p.31
3.1. Etude de l’offre fourragère p.31
3.2. Etude de l’intérêt écologique p.33
3.2.1. Typologie des habitats p.33
3.2.2. Espèces végétales patrimoniales p.35
3.2.3. Peuplements d’orthoptères p.36
3.3. Analyse fonctionnelle de la végétation p.38
4. Discussion p.42
4.1. Enjeux pour la gestion pastorale p.42
4.2. Critique méthodologique p.45
Conclusion p.46
Table des figures p.47
Tables des tableaux p.47
Bibliographie p.48
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
1
/
74
100%