Trousse ELISA de détection des anticorps contre le virus de la

INTERPRÉTATION
Calcul du pourcentage d’inhibition
Calculer la moyenne (M) des DO obtenues pour le sérum contrôle négatif (N). Diviser la DO obtenue pour
chacun des échantillons par la MDO N. Par la suite, soustraire ce résultat de 1 et multiplier par 100 pour obtenir
le pourcentage (%) d’inhibition.
Pourcentage d’inhibition (%) = ⎥
⎦
⎤
⎢
⎣
⎡⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
−NMDO
DO
1 X 100
Critères de validité
Les critères suivants doivent être satisfaits pour que l’épreuve soit considérée valide:
DO
Moyenne des DO du contrôle positif (MDO P) < 0.3
Moyenne des DO du contrôle négatif (MDO N) > 0.9
Interprétation
• % d’inhibition d’échantillon éprouvé ≥55%: positif pour la présence d’Ac contre le VGET.
• Un % d’inhibition <45%: négatif pour la présence d’Ac contre le VGET.
• Un % d’inhibition ≥45% mais <55%: douteux pour la présence d’Ac contre le VGET.
BIBLIOGRAPHIE
1. Saif LJ and Wesley RD. Transmissible Gastroenteritis and Porcine Respiratory Coronavirus. In: Straw BE,
D’Allaire S, Mengeling WL, Taylor DJ, eds. Diseases of Swine. 8th ed. Ames, Iowa: Iowa State University
Press; 1999:295-325.
2. Office International des Epizooties (O.I.E), World organisation for animal health. Transmissible
gastroenteritis. In: Manual of Standards for Diagnostic Tests and Vaccines, fourth edition, 2000: 638-646.
3. López L, Venteo A, García M, Camuñas A, Ranz A, García J, Sarraseca J, Anaya C, Rueda P. Antigen-
capture blocking enzyme-linked immunosorbent assay based on a baculovirus recombinant antigen to
differentiate Transmissible gastroenteritis virus from Porcine respiratory coronavirus antibodies. J Vet
Diagn Invest. 2009 Sep;21(5):598-608.
Trousse ELISA de détection des anticorps contre le virus de la
gastroentérite transmissible du porc
Swinecheck® TGEV Recombinant
Monographie
2013-02-28
Cette trousse est basée sur une épreuve immunoenzymatique destinée au dépistage des anticorps contre le
virus de la gastroentérite transmissible (VGET) dans le sérum porcin.
La gastroentérite transmissible (GET) est une maladie entérique contagieuse du porc causée par le VGET. Le
VGET affecte les porcs de tout âge. Il se multiplie au niveau des tractus digestif et respiratoire et cause des
vomissements et de la diarrhée. Le taux de mortalité chez les porcelets âgés de moins de 2 semaines est proche
de 100%. Chez les porcs plus âgés, la maladie est moins sévère voire parfois inapparente.1-3
Un diagnostic rapide et précis de la GET est indispensable afin de prévenir la dissémination de la maladie.
Celui-ci repose principalement sur la mise en évidence du virus. Toutefois, la détection des anticorps est très
utile chez les porcs âgés qui ne présentent pas toujours des signes typiques de la maladie. Des examens
sérologiques sont également régulièrement exigés lors des échanges commerciaux.
Les anticorps dirigés contre le VGET peuvent être détectés à l’aide du test de neutralisation de virus (VN). Par
contre le test VN nécessite des installations permettant de faire de la culture cellulaire ainsi que l’utilisation de
VGET infectieux, ce qui limite son utilisation aux laboratoires spécialisés. De plus, c’est un test qui requiert du
temps et les résultats ne sont seulement disponibles qu’après plusieurs jours. Au contraire, les tests ELISA
peuvent être effectués dans la plupart des laboratoires et les résultats sont disponibles après quelques heures.
L’utilisation d’anticorps monoclonaux spécifiques au virus VGET dans une épreuve ELISA de blocage permet
de détecter les anticorps résultant de l’infection par le VGET alors que les anticorps dirigés contre le
coronavirus respiratoire porcin, un coronavirus porcin très semblable au VGET, ne sont pas détectés. La
spécificité du test est encore améliorée par l’utilisation d’une protéine recombinante comme antigène3.
PRINCIPE DU TEST
Les échantillons de sérum porcin ainsi que les contrôles sont incubés dans des puits dans lesquels est adsorbée
la protéine S recombinante du VGET. Les anticorps (Ac) spécifiques au VGET éventuellement présents dans
les échantillons se fixent à la protéine dans les puits. Après plusieurs lavages pour éliminer les substances non
liées, un Ac monoclonal (AcMo) couplé à une enzyme (conjugué) et spécifique au VGET est ajouté. Cet
AcMo se fixe aux sites de la protéine qui ne sont pas occupés par les Ac présents dans les échantillons positifs.
Après incubation, l’excédent de conjugué est éliminé par lavages successifs. La liaison du conjugué à la
protéine est révélée avec un substrat chromogène. En présence de la portion enzymatique du conjugué, le
chromogène réagit et provoque le développement d’une coloration bleue. La réaction enzymatique est arrêtée
(la couleur passe de bleu à jaune) et les densités optiques sont mesurées. L’intensité de la coloration indique la
nature des échantillons. Un échantillon fortement positif est révélé par une réaction faible (jaune pâle). À
l’inverse, un échantillon négatif est révélé par une réaction forte (jaune foncé). Toute intensité de réaction se
situant entre le jaune foncé et le jaune pâle représente divers degrés de positivité.

MATÉRIEL PROCÉDURE
Composantes Quantité
• 12 barrettes de 8 puits où est adsorbée la protéine S recombinante du VGET 2
• Contrôle positif prêt à l’emploi 2 mL
• Contrôle négatif prêt à l’emploi 2,5 mL
• Tampon de dilution des échantillons prêt à l’emploi (vert) 30 mL
• Conjugué prêt à l’emploi (bleu) 2 X 11 mL
• Solution de lavage concentrée (10X)* 125 mL
• Substrat prêt à l’emploi 25 mL
• Solution d’arrêt prête à l’emploi 25 mL
* Des cristaux peuvent se former lorsque la solution de lavage concentrée est conservée à 2-7°C. Ce phénomène
n’affecte pas la performance du produit. Avant utilisation, laisser la solution à la température ambiante pendant
quelques minutes afin de dissoudre les cristaux.
Le matériel inclus permet de tester jusqu’à 184 échantillons en un seul test en les répartissant sur les 2
microplaques et en disposant les contrôles appropriés sur chacune des microplaques.
Matériel requis mais non fourni:
• Eau purifiée
• Micropipettes de précision (mono et multicanaux)
• Embouts de micropipette à usage unique
• Système de lavage de microplaques (facultatif)
• Tubes pour la dilution des échantillons
• Lecteur de microplaques à 96 puits muni d’un filtre de 450 nm
• Contenants à dilution pour certaines solutions
PRÉCAUTIONS
• Pour usage vétérinaire in vitro seulement.
• Ne pas utiliser la trousse après la date de péremption qui figure sur l’étiquette.
• Ne pas mélanger les composantes en provenance de trousses de séries différentes.
• La sensibilité et la spécificité du test ne peuvent être garanties qu'à condition de suivre rigoureusement le
protocole du test.
• Conserver toutes les composantes à 2-7°C et les amener à la température ambiante avant leur utilisation
(les conjugués non utilisés doivent être rangés le plus rapidement possible à 2-7°C).
• Le matériel utilisé doit être considéré comme infectieux et doit être décontaminé avant son élimination.
• Ne pas exposer le substrat à la lumière ou à un agent oxydant. Toujours entreposer cette solution dans un
récipient de plastique. Cette solution peut provoquer une irritation de la peau ou des yeux.
• La solution d’arrêt contient un acide fort et doit être manipulée avec précaution pour éviter tout contact
avec la peau ou les muqueuses.
• Disposer du substrat et de la solution d’arrêt selon les réglementations locales pour les produits
chimiques.
A. Préparation des échantillons
Diluer les échantillons de sérum porcin 1/2 avec le tampon de dilution des échantillons (ex.: 200 µL de
l’échantillon dans 200 µL de tampon de dilution). Utiliser des embouts différents pour chaque
échantillon et homogénéiser chaque dilution avant de la distribuer dans les puits.
B. Préparation de la solution de lavage
Après homogénéisation de la solution de lavage concentrée (absence de cristaux), effectuer une
dilution 1/10 avec de l’eau purifiée (ex.: 100 mL de concentré 10X dans 900 mL d’eau purifiée pour
chaque plaque éprouvée). Après dilution, la solution (1X) est stable pendant une semaine à 2-7°C.
C. Lavages
LA QUALITÉ DES LAVAGES EST ESSENTIELLE À L’OBTENTION DE RÉSULTATS
APPROPRIÉS. Il est fortement recommandé d’effectuer les lavages à l’aide d’un laveur de
plaque automatique ou d’une pipette (ne pas utiliser de flacon laveur). Il est important
d’éliminer le liquide contenu dans la plaque après chaque lavage et, après le dernier lavage,
de drainer tout liquide résiduel sur du papier absorbant. Faire également attention à ne pas
mélanger le contenu des puits.
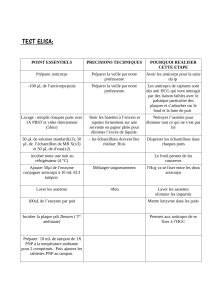
D. Protocole du test
Amener tous les réactifs à la température ambiante et les homogénéiser par agitation manuelle avant de
les utiliser.
Ranger les conjugués non utilisés le plus rapidement possible à 2-7°C.
1. Établir un schéma de la plaque pour la répartition des contrôles et des échantillons.
2. Distribuer 100 µL de contrôle positif prêt à l’emploi, de contrôle négatif prêt à l’emploi ou des
échantillons dilués (voir section A) dans les puits appropriés (il est recommandé de tester les
contrôles en duplicata).
3. Couvrir les puits et incuber pendant 1 heure à 37 ± 1°C.
4. Laver chacun des puits 3 fois avec 300 μL de solution de lavage 1X (voir sections B et C).
5. Distribuer 100 μL du conjugué prêt à emploi dans chacun des puits.
6. Couvrir les puits et incuber pendant 30 minutes à 37 ± 1°C.
7. Laver chacun des puits 6 fois avec 300 μL de solution de lavage 1X (voir sections B et C).
8. Distribuer 100 μL de substrat prêt à l’emploi dans chacun des puits.
9. Couvrir les puits et incuber, à l'abri de la lumière, pendant 10 minutes à 23 ± 2°C.
10. Distribuer 100 μL de la solution d’arrêt prête à l’emploi dans chacun des puits.
11. Mesurer la densité optique (DO) de chacun des puits à 450 nm. La mesure doit être effectuée au
plus tard 15 minutes après l’arrêt de la réaction.
12. Calculer les résultats.
1
/
2
100%