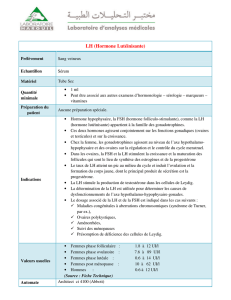
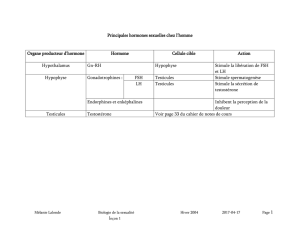
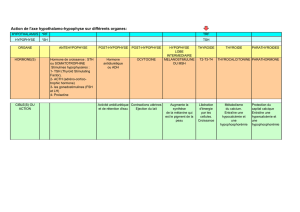
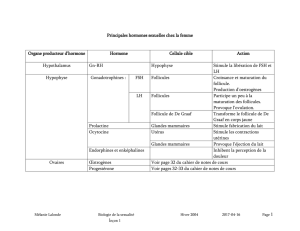
nhibine, FRP et activine - iPubli

NOUVELLES
47
ooo
90 K 90 ooo
1.
"c
14

7.
·
1
/
2
100%