Atelier Universitaire (Winter School)

M2BBMC
SEMAINESTHEMATIQUES
UNIVERSITECATHOLIQUEDELOUVAIN

1- EVOLUTION DIRIGEE DES PROTEINES
Organisateurs : Patrice SOUMILLION & Bernard HALLET
Date : semaine du 6/10.
Nombre de participants : minimum 8, maximum 20
Objectifs et contenu
Cet atelier vise à introduire les participants au monde de l’ingénierie des protéines tant d’un point
de vue théorique que pratique. Plusieurs exposés sur des sujets variés entrecouperont une semaine
de travaux pratiques centrée sur la technologie du phage display.
1. Exposés
Chaque jour, un exposé de 2 heures fera le point sur un domaine particulier ou une technique
courante dans le domaine de l’évolution dirigée des protéines. Cinq exposés sont prévus :
- Les méthodes de construction de la diversité génétique : PCR mutagénisante, DNA
shuffling, incorporation d’oligonucléotides dégénérés…
- La technologie du phage display, une méthode sélective robuste et puissante pour
l’ingénierie de ligands protéiques.
- Les méthodes de criblage à haut débit pour l’ingénierie des enzymes.
- L’évolution dirigée permet-elle de créer des activités catalytiques de novo ? L’exemple
des anticorps catalytiques.
- Les méthodes de compartimentalisation artificielle vont-elles révolutionner le domaine
de l’évolution dirigée ?
2. Travaux pratiques : ingénierie de beta-lactamases allostériques par phage display
Pendant les 5 jours de l’atelier, les participants auront l’occasion de se familiariser
expérimentalement avec la technologie du phage display. Une collection d’enzymes mutantes
présentées en surface de phages sera utilisée pour réaliser un tour de sélection par capture
d’affinité à l’aide du support sur lequel sont immobilibés des ions Ni++. Les méthodes qui
permettent d’évaluer les performances de la sélection seront abordées. Parmi les enzymes
mutantes sélectionnées, nous tenterons également d’identifer celles qui sont allostériquement
régulées par le Ni++.

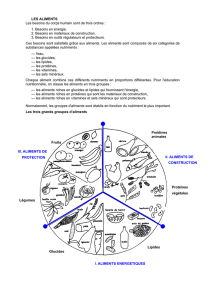
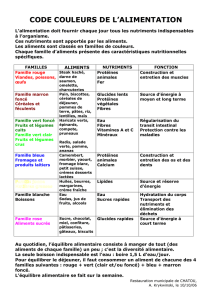
2- ALIMENTATION & SANTÉ
Organisateurs : Cathy DEBIER, Yvan LARONDELLE, Claude REMACLE,
Brigitte REUSENS & Yves-Jacques SCHNEIDER
Date : semaine du 13/10.
Nombre de participants : minimum 10, maximum 24.
Contenu envisagé
Les titres sont indicatifs et le nom des orateurs possibles (mais non contactés à ce jour) sont entre
( ).
Lundi
Accueil des participants par les organisateurs.
Cadrage diététique de la relation entre alimentation et santé : recommandations diététiques
(Véronique Maindiaux, IPL)
Nutriments et maladies cardio-vasculaires
Absorption du cholestérol (André Scheen, ULg)
Lipides et santé cardio-vasculaire (Yvon Carpentier, ULB)
Mardi
Nutriments et tissu adipeux (ou/et obésité ?)
… (Isabelle Dugail, Paris)
… (Sonia Brichard, UCL)
Régulation de l’appétit (Nathalie Delzenne, UCL)
Mercredi
Nutriments et diabète
Diabète (Jean-Paul Thissen)
Programmation et diabète (Brigitte Reusens ou/et Claude Remacle, UCL)
Epigénétique et programmation (Claudine Junien, Paris)
Jeudi
Nutriments, inflammation et cancers
Flore bactérienne et inflammation (Patrice Cani, UCL
Nutriments et inflammation intestinale (Yves-Jacques Schneider, UCL)
Nutriments et cancers (Yvan Lrondelle)
Vendredi
Aliments et santé publique
Epidémiologie (Stephaan De Henauw, U Gent)
Réglementation actuelle (Jean Pottier, AFSCA)
Exposés par les étudiants sur un thème prédéfini lié aux exposés.
TP « surprise » : application culinaire des concepts vus pendant la semaine.

3- TRANSPORTEURS ET TRAFIC MEMBRANAIRE
Organisateurs : Henri BATOKO, Marc BOUTRY, François CHAUMONT, Bernard
KNOOPS, Pierre MORSOMME
Date : semaine du 20/10.
Nombre de participants : minimum ?, maximum 12
Objectifs et contenu
Cet atelier offrira aux participants la possibilité de comprendre et de mettre en pratique les
approches et techniques de laboratoire permettant d’étudier chez les cellules eucaryotes :
1) l’adressage des protéines dans les compartiments subcellulaires
2) la fonction et la régulation de transporteurs membranaires.
1. Expression et localisation subcellulaire de protéines eucaryotes
Contrairement aux cellules procaryotes, l’intérieur des cellules eucaryotes est subdivisé en
compartiments membranaires ou organites. Chaque organite a une composition protéique unique.
Les participants utiliseront des protéines fluorescentes comme exemples pour comprendre les
mécanismes d’adressage subcellulaire de protéines, marquer et visualiser in vivo (microscopie à
épifluorescence et microscopie confocale) différents compartiments subcellulaires, comparer leur
organisation et dynamique chez des cellules microbiennes, animales et végétales. Des méthodes
de transfection de cellules animales (cellules humaines en culture, ovocytes de Xénope), de
cellules végétales et de levure seront pratiquées.
2. Expression et caractérisation de transporteurs membranaires
Les protéines membranaires représentent plus d’un quart des protéines cellulaires mais requièrent
des techniques particulières pour être caractérisées. A travers des exemples précis, les participants
apprendront à exprimer (expression homologue et/ou hétérologue), solubiliser et purifier des
transporteurs membranaires de cellules eucaryotes. Les techniques de caractérisation biochimique
(activité enzymatique, transport vectoriel, SDS-PAGE, Western blot…) seront utilisées pour
comprendre les relations structure-fonction de ces protéines.
Les participants apprendront des approches permettant d’étudier et de quantifier le transport in
vivo (protons et molécules d’eau) à travers la membrane plasmique, et analyseront le rôle
physiologique et les mécanismes de régulation des transporteurs impliqués.
Organisation et structure de l’atelier
Cet atelier sera essentiellement pratique, avec des explications théoriques nécessaires à la
compréhension des différentes expériences. Les expériences s’étaleront sur 4,5 jours, l’après-midi
de vendredi étant consacré à une discussion collective des résultats individuels ou de groupe, et à
la préparation du rapport qui servira à l’évaluation.

M2BBMC
SEMAINESTHEMATIQUES
FUNDP
 6
6
 7
7
1
/
7
100%