اﻟﻌﺎدﯾﺔ ۲۰۱۲ دورة اﻟﻌﺎم ﺎﻧوﯾﺔ اﻟﻌﺎﻣﺔ اﻣﺗﺣﺎﻧﺎت اﻟﺷﮭﺎدة

ﺛﻟا ةدﺎﮭﺷﻟا تﺎﻧﺎﺣﺗﻣا ﻲﻟﺎﻌﻟا مﯾﻠﻌﺗﻟاو ﺔﯾﺑرﺗﻟا ةرازو ﺔﻣﺎﻌﻟا ﺔﯾوﻧﺎ مﺎﻌﻟا ةرود۲۰۱۲ ﺔﯾدﺎﻌﻟا
ﺔﻣﺎﻌﻟا موﻠﻌﻟا : عرﻔﻟا ﺔﯾﺑرﺗﻠﻟ ﺔﻣﺎﻌﻟا ﺔﯾرﯾدﻣﻟا
تﺎﻧﺎﺣﺗﻣﻻا ةرﺋاد
:مﺳﻻا ءﺎﯾﻣﯾﻛﻟا ةدﺎﻣ ﻲﻓ ﺔﻘﺑﺎﺳﻣ
نﺎﺗﻋﺎﺳ: ةدﻣﻟا : مﻗرﻟا
Cette épreuve est constituée de trois exercices. Elle comporte quatre pages numérotées de 1 à 4.
L’usage d’une calculatrice non programmable est autorisé.
Traiter les trois exercices suivants :
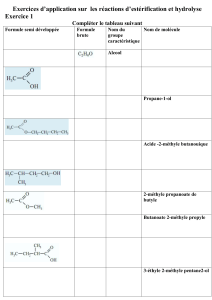
Premier exercice (7 points)
Identification d’un composé organique
On dispose d’un composé organique (A) de formule brute CxHyO à chaîne carbonée saturée et non cyclique.
Le but de cet exercice est de reconnaître la famille chimique du composé (A) afin de l’identifier.
1- Identification de la famille chimique de (A)
1.1- Citer quatre familles chimiques organiques possibles que peut représenter le composé (A).
1.2- Dans le but d’identifier la famille chimique de (A), on effectue les deux tests suivants :
Premier test
On réalise l’oxydation ménagée d’un échantillon de (A). On obtient un composé organique (B) qui, dissous
dans l’eau, donne une solution de pH nettement inférieur à 7.
Deuxième test
On ajoute à un autre échantillon de (A) quelques gouttes de 2,4- D.N.P.H. Un précipité jaune- orangé
apparaît.
1.2.1- Montrer que le composé organique (B) est un acide carboxylique.
1.2.2- Déduire, de ces deux tests, la famille chimique de A.
2- Identification du composé (A)
Données :
• Masses molaires atomiques en g.mol-1 : M(H) = 1 ; M(C) = 12 ; M(O) = 16.
•
Indicateur coloré
Zone de virage
Hélianthine
3,1 - 4,4
Phénolphtaléine
8,2 - 10
Dans le but, d’identifier le composé (A), on procède de la façon suivante :
- On prépare une solution (S) en dissolvant 1,41 g de l’acide (B) dans l’eau distillée de telle façon à avoir
un volume V = 250 mL.
- On dose un volume Va = 20,0 mL de la solution (S) par une solution d’hydroxyde de sodium (Na+ + HO –)
de concentration Cb = 0,10 mol.L-1, en présence d’un indicateur coloré convenable.
Le volume de base ajoutée pour atteindre l’équivalence est VbE = 15,2 mL.
1

2.1- Choisir, du matériel donné ci-après, celui nécessaire à la réalisation de ce dosage :
Bécher de 100 mL, éprouvette graduée de 20 mL, burette graduée de 25 mL, agitateur magnétique,
pH-mètre et pipette jaugée de 20 mL.
2.2- Ecrire l’équation de la réaction de dosage, en représentant l’acide par la formule R – COOH.
2.3- Choisir, en justifiant, des deux indicateurs colorés donnés ci-avant, celui qui est convenable pour
repérer la fin du dosage.
2.4- Déterminer la concentration de la solution (S) en acide (B).
2.5- Montrer que la masse molaire de (B) est proche de 74 g.mol-1.
2.6- Déduire la formule moléculaire de (B).
2.7- Identifier le composé (A).
Deuxième exercice (6 points)
Cinétique d’une réaction d’estérification
On se propose d’étudier la cinétique de formation d’un ester, à odeur de banane, à partir d’un mélange de
0,20 mol d’acide éthanoïque et 0,20 mol de 3-méthylbutan-1-ol, en présence d’acide sulfurique comme
catalyseur.
Par une méthode appropriée, on a déterminé la quantité formée de cet ester, n(ester), au cours du temps. Les
résultats sont groupés dans le tableau suivant :
t (min)
2
5
10
15
20
30
45
60
n(ester) (10-2 mol)
4,2
7,4
10,0
11,2
12,0
12,7
13,2
13,4
1- Etude de la réaction d’estérification
L’acide éthanoïque et le 3-méthylbutan-1-ol réagissent selon l’équation générale:
R – COOH + R1 – CH2 OH ⇄ R – COO – CH2 – R1 + H2O
La constante associée à cet équilibre homogène est KC = 4,12.
1.1- Ecrire la formule semi-développée de l’acide éthanoïque, de 3-méthylbutan-1-ol et de l’ester formé.
Nommer cet ester.
1.2- Montrer, à partir de la valeur de la constante KC , que le mélange réactionnel atteint l’état
d’équilibre à t = 60 min.
1.3- Vérifier si la réaction d’estérification s’arrête à t = 60 min.
2- Etude cinétique
2.1- Tracer la courbe représentant la variation de la quantité d’ester formé au cours du temps :
n(ester) = f (t) dans l’intervalle de temps [0 – 60 min].
Prendre les échelles suivantes: 1cm pour 5 min en abscisses et 1 cm pour 1,0.10-2 mol en ordonnées.
2.2- Déterminer la vitesse de formation de cet ester à t = 15 min.
2.3- On reprend cette étude cinétique dans les mêmes conditions expérimentales mais sans utiliser le
catalyseur. Tracer, sur le même graphe de la question 2.1, l’allure de la courbe représentant la
nouvelle variation : n(ester) = g (t). Justifier.
2.4- Pour rendre la réaction de la préparation de cet ester plus rapide et totale, on utilise à la place de
l’acide éthanoïque un composé (G). Ecrire les formules semi-développées possibles de (G).
2

Troisième exercice (7 points)
Réactions acido-basiques
On dispose de deux flacons contenant chacun une des deux solutions basiques suivantes :
- S1 : solution d’hydroxyde de potassium (K+ + OH –) de concentration molaire C1.
- S2 : solution d’ammoniac NH3 de concentration molaire C2.
Les deux solutions S1 et S2 ont la même valeur de pH qui est 10,6.
Données :
• Produit ionique de l’eau : Ke = 1,0.10-14.
• La réaction de l’ammoniac avec l’eau est limitée.
• NH4Cl est un composé ionique très soluble dans l’eau.
•
33
44
[NH ] %(en mol)NH
[NH ] %(en mol)NH
++
=
.
1- Base forte et base faible
1.1- Calculer la concentration C1.
1.2- Comparer, en justifiant, C1 et C2.
2- Détermination du pKa du couple NH
+
4
/ NH3
Une solution (S) d’ammoniac, de concentration C = 5,0.10-3 mol.L-1, est préparée en dissolvant du gaz
ammoniac dans l’eau distillée.
2.1- Ecrire l’équation de la réaction entre l’ammoniac et l’eau.
2.2- Déterminer la somme des concentrations de l’ammoniac, [NH3], et des ions ammonium, [NH
4
+
],
dans la solution préparée.
2.3- On dissout dans un échantillon de cette solution quelques cristaux de chlorure d’ammonium NH4Cl,
sans variation du volume de cet échantillon.
Préciser la variation du pH lors de cette dissolution.
2.4- Le graphe, ci-après, représente la variation des pourcentages (en mol) des espèces acide et basique du
couple NH
+
4
/ NH3 dans la solution (S) en fonction du pH.
0%
20%
40%
60%
80%
100%
78910 11 12
pH
<
Courbe 1
Courbe 2
3

2.4.1- Identifier les deux courbes 1 et 2.
2.4.2- Déterminer, à partir du graphe, le pKa du couple NH
+
4
/ NH3.
2.5 - Il est possible de préparer une solution tampon de pH égal au pKa du couple NH
+
4
/ NH3 en mélangeant
deux solutions parmi celles proposées dans le tableau ci-dessous.
Solution 1
Solution 2
Solution 3
Solution 4
Ammoniac
Hydroxyde de
potassium
Acide
chlorhydrique
Acide
chlorhydrique
C = 5.10-3 mol.L-1
V1 = 400 mL
C = 5.10-3 mol.L-1
V2 = 200 mL
C = 5.10-3 mol.L-1
V3 = 400 mL
C = 5.10-3 mol.L-1
V4 = 200 mL
2.5.1- Ecrire l’équation de la réaction qui a lieu lors du mélange de ces deux solutions.
2.5.2- Déterminer la constante, KR , de cette réaction et déduire qu’elle est totale.
2.5.3- Préciser les deux solutions à mélanger pour préparer cette solution tampon.
4

5
 6
6
 7
7
 8
8
 9
9
1
/
9
100%