S3F1. P2. texte - Ent Paris 13

Université Paris 13. UFR SMBH. Licence Sciences du Vivant.
L2. UE S3F1. Génétique 2.
PARTIE II. GÉNÉTIQUE DES POPULATIONS
COURS
Introduction
● La génétique est une discipline qui étudie la transmission de l'information héréditaire et son utilisation dans le développement et le
fonctionnement des organismes.
La génétique des populations est une discipline de la génétique quantitative. Elle étudie la diversité génétique des espèces et des
populations ainsi que la façon dont celle-ci change au cours du temps. Elle permet de donner le profil génétique (ou structure
génétique) d’une population.
● Lorsque Charles Darwin a identifié la sélection naturelle comme mécanisme moteur de l'évolution adaptative, vers le milieu du 19
e
siècle, il n'existait pas de modèle pour expliquer les mécanismes responsables de la variation et de la transmission des caractères.
En effet, Gregor Mendel ne publia son travail sur l'hérédité des caractères que vers la fin du 19
e
siècle et celui-ci n'eut que peu
d'impact à ce moment-là.
L'année 1900, avec la redécouverte des travaux de Mendel, vit débuter une période de 30 ans qui permit de réconcilier les concepts
de gènes et d'allèles de Mendel avec ceux de la théorie de l'évolution. La synthèse de ces deux approches permit aux biologistes de
réaliser que la fréquence d'un caractère phénotypique dans une population est liée à l'abondance relative des allèles responsables
de ce caractère. Cette réflexion aboutit à la naissance de la génétique des populations.
● Nous verrons dans ce cours que les fréquences alléliques dans une population peuvent varier dans l'espace et dans le temps,
que les relations entre fréquences alléliques et génotypiques dans une population idéale sont définies par la loi de Hardy-Weinberg
et enfin que des forces majeures (sélection, migration...) dirigent l'évolution des populations.
I. VARIATIONS SPATIO-TEMPORELLES DANS LE POOL GENIQUE D'UNE POPULATION
Une population est donc un groupe d’individus partageant un ensemble commun de gènes, qui vivent dans une même aire
géographique et sont réellement ou potentiellement interféconds.
Une population (ou population mendélienne) peut être considérée comme un groupe d'organismes génétiquement apparentés
(appartenant à la même espèce, sous-espèce, race, variété, souche) vivant dans une région géographiquement définie et aptes à
se reproduire sexuellement grâce aux croisements entre ses individus.
Tous les allèles partagés par ces individus constituent le pool génique (ou pool de gènes, pool allélique) de la population. Le pool
génique varie au cours du temps au fur et à mesure que de nouveaux allèles s’y intègrent ou que d’anciens allèles le quittent à la
suite d’événements tels que la sélection naturelle, la migration ou la mutation (Figure 2).
Les éléments clés qui sont pris en compte pour décrire la structure génétique d'une population sont les suivants :
- l'évaluation des fréquences alléliques (ou fréquences géniques)
- l'évaluation des fréquences génotypiques
- la variation des deux fréquences précédentes au cours des générations.
La fréquence allélique est définie comme le rapport du nombre de copies de l'allèle considéré par la somme de toutes les copies de
tous les allèles. Dans le formalisme mathématique en génétique des populations, la fréquence de l'allèle dominant est notée p et
celle de l'allèle récessif est notée q.
Les génotypes sont-ils distribués au hasard dans l'espace et le temps ? Existe-t-il une structuration de la variation ? Quels sont les
processus qui affectent le pool de gènes de la population ?
Les populations ne sont pas statiques, elles sont dynamiques :
- elles se contractent ou s’étendent en fonction des taux de natalité et de mortalité, des migrations ou de contacts avec d’autres
populations ;
- certains individus ont une descendance plus importante que d’autres (augmentation de leurs propres allèles dans la population à la
génération).
Le pool génique varie au fur et à mesure que de nouveaux allèles s'y intègrent ou que d'anciens allèles le quittent à la suite
d'événements tels que la sélection naturelle, la migration ou la mutation. Ces variations sont à l'origine de l'évolution. L'évolution
peut être observée au niveau des allèles et de leur variation de fréquence (micro-évolution) ou à l'échelle des temps géologiques
avec l'extinction et l'émergence de nouvelles espèces (macro-évolution).
Aujourd’hui, les approches moléculaires permettent de mesurer des évolutions dans l’ADN.
II. MODELE DE HARDY-WEINBERG
La loi de Hardy-Weinberg décrit des relations entre fréquences alléliques et fréquences génotypiques dans une population idéale.
Un modèle mathématique permet de le faire de manière élégante. Ce modèle a été développé indépendamment par le
mathématicien anglais Hardy et le médecin allemand Weinberg vers 1900.
Le modèle de Hardy-Weinberg utilise les lois de ségrégation mendéliennes et de simples probabilités pour exprimer la relation entre
fréquences alléliques et fréquences génotypiques dans une population.
A. Structure génétique de deux populations hypothétiques
Considérons le cas hypothétique d'un organisme diploïde possédant deux allèles d'un gène, soit A et a. Dans une population de 300
individus, supposons qu'il y ait 147 individus de génotype AA, 126 Aa et 27 aa.
A partir de ces valeurs, on peut calculer les fréquences des allèles A et a.
La fréquence de l'allèle A est p = (2 x 147 + 126) / 600 = 0,7. Elle est déterminée en comptant simplement tous les allèles A chez les
individus AA soit 2 x 147, chez les individus Aa soit 126, et en divisant ce nombre par le nombre total de copies d'allèles de cette
paire chez les 300 individus, soit 600.
De même la fréquence de l'allèle a est égale à q = (2 x 27 + 126) / 600 = 0,3.
Si maintenant, la population se reproduit par croisement au hasard, de sorte que tous les accouplements possibles puissent avoir
lieu, nous pouvons prédire la distribution des trois génotypes dans la génération suivante à partir des valeurs de fréquences
alléliques que nous venons de calculer.

On voit dans le tableau de la figure 3 que les proportions des trois génotypes de la génération F1 recoupent exactement celles
qu'on trouvait chez les parents. Nous pouvons remarquer que la fréquence de l'allèle A est toujours de 0,7 et celle de l'allèle a de
0,3. Ce rapport se maintiendra au cours des générations successives tant que les croisements se feront au hasard.
Cependant on peut objecter que les deux groupes de valeurs se recouvrent étroitement parce que nous avons calculé les
fréquences des allèles à partir des valeurs initiales de la distribution des génotypes dans la population parentale et qu'on a tourné
en rond.
Nous pouvons démontrer qu'il n'en est rien en examinant une seconde population tout aussi hypothétique, dans laquelle, parmi 300
individus, il y a 190 individus AA, 40 Aa et 70 aa.
Là-aussi la fréquence des allèles est de 0,7 pour A et de 0,3 pour a.
Si les individus de cette population sont croisés au hasard, les génotypes de la progéniture auront les mêmes fréquences relatives
que celles que nous avons calculées dans l'exemple précédent, c'est-à-dire des valeurs très différentes de celles de leurs parents.
B. Formalisation de la loi de Hardy-Weinberg
Lorsque l'on considère une paire d'allèles Aa d'un même locus, le pourcentage portant A ou a dans le pool de gènes dépend de la
fréquence génotypique de la génération parentale dont les gamètes forment le pool. Par exemple, si la majorité de la population a le
génotype récessif aa, alors la fréquence de l'allèle récessif dans le pool de gènes serait relativement élevée, et le pourcentage de
gamètes portant l'allèle A serait réciproquement bas.
Lorsque les croisements entre les membres d'une population s'effectuent complètement au hasard, c'est-à-dire que chaque gamète
mâle d'une population a une opportunité égale de rencontrer un gamète femelle, alors la fréquence zygotique attendue de la
génération suivante peut être prédite par l'extrapolation des fréquences alléliques du pool de gènes de la population parentale.
Etant donné la fréquence relative des gamètes A et a dans le pool de gènes, on peut calculer (en supposant l'union aléatoire des
gamètes) les fréquences attendues des génotypes et des phénotypes des descendants. On peut utiliser l'échiquier de Punnet pour
produire toutes les combinaisons possibles (Figure 4).
Une population idéale au sens d’Hardy-Weinberg doit être infiniment grande, les croisements doivent se faire au hasard (panmixie),
la population ne doit être soumise à aucune force évolutive (mutation, migration, sélection naturelle).
Autrement dit, la validité des prévisions d'équilibre génétique selon l'équation de Hardy-Weinberg dépend de plusieurs conditions :
- l'effectif de la population est assimilé à l'infini et les croisements s'effectuent de manière aléatoire (panmixie)
- il n'y a aucune sélection, c'est-à-dire que tous les génotypes ont une chance égale de survie (il n'y a pas de mortalité différentielle)
ainsi qu'une efficacité équivalente de produire une descendance (il n'y a pas de reproduction différentielle)
- la population est fermée, c'est-à-dire que les migrations de populations ne sont pas permises
- il n'y a pas de mutation d'allèles. Les mutations ne sont permises que si les taux de mutation et de réversion sont équivalents,
c'est-à-dire que les fréquences de mutation de A en a et l'inverse sont équivalentes
- la méiose est normale, donc le hasard est le seul facteur agissant sur la gamétogenèse.
Sous ces conditions, le modèle de Hardy-Weinberg permet d’effectuer deux prévisions :
- Les fréquences des allèles du pool de gènes ne changent pas au cours du temps. Si on considère deux allèles A et a présents à
un locus, on a toujours p + q = 1. Avec p = fréquence de l’allèle A et q = fréquence de l’allèle a
- Toujours avec les mêmes allèles, après une génération de croisements au hasard, les fréquences des génotypes (AA), (Aa) et (aa)
dans la population sont calculées de la façon suivante :
(p + q)
2
= p
2
+ 2pq + q
2
= 1 où p = fréquence de l’allèle A et q = fréquence de l’allèle a
Une population qui répond à cette double exigence est dite à l’équilibre de Hardy-Weinberg.
Cet ensemble de conditions peut sembler d'une exigence extrême mais il existe des populations humaines (ou d'autres espèces)
qui sont en équilibre génétique pour certains allèles. Il faut remarquer que si une population n'est pas à l'équilibre, il suffit d'une
seule génération de croisements au hasard pour l'y ramener. Ceci est démontré par la seconde population que nous avons
envisagée.
En spécifiant les conditions selon lesquelles une population ne peut pas évoluer, le modèle de Hardy-Weinberg identifie les
mécanismes responsables des changements de fréquences alléliques ou génotypiques. En d'autres termes, en maintenant
certaines conditions constantes, ce modèle permet d'isoler et de quantifier certaines forces responsables de l'évolution.
L'application du modèle de Hardy-Weinberg peut également révéler les gènes neutres du pool génique d'une population, ceux qui
ne sont pas sensibles aux forces sélectives de l'évolution.
Il y a trois autres conséquences importantes de la loi de Hardy-Weinberg. Premièrement, elle montre que les caractères dominants
ne voient pas leur fréquence augmenter d'une génération à la suivante. Deuxièmement, elle démontre la variabilité génétique peut
être maintenue dans une population si, une fois établies dans une population idéale, les fréquences alléliques restent inchangées.
Troisièmement, lorsque l'on pose les hypothèses du modèle de Hardy-Weinberg, la connaissance de la fréquence d'un seul
génotype permet de déduire les fréquences génotypiques des autres génotypes pour le locus considéré.
Ceci est particulièrement utile en génétique humaine car il est possible de calculer la fréquence des hétérozygotes porteurs de
maladies génétiques récessives, lorsque la seule information disponible est la fréquence des individus malades.
C. Remarque
Si on définit l'évolution comme tout changement de fréquence allélique d'une population, alors la violation d'une ou plusieurs des
restrictions de Hardy-Weinberg éloignerait la population des fréquences d'équilibre (situation de déséquilibre). Des changements de
fréquences alléliques peuvent être produits par l'erreur d'échantillonnage dans une population très petite (dérive génétique) par la
sélection, la migration ou la mutation, ou encore par la ségrégation préférentielle (non aléatoire) des chromosomes (dérive
méiotique).
III. APPLICATIONS DE LA LOI DE HARDY-WEINBERG
A. Calculs classiques de fréquences génotypiques et alléliques
1. Locus autosomiques bialléliques (allèles autosomiques dominant et récessif)
La détermination des fréquences génotypiques pour des allèles ayant des relations de dominance et récessivité nécessite une
approche ordonnée. Un phénotype dominant pourrait avoir l'un des deux génotypes AA ou Aa, mais nous n'avons aucun moyen de

distinguer le nombre d'homozygotes et d'hétérozygotes dans notre échantillon. Le seul phénotype dont le génotype soit connu de
manière certaine est le récessif (aa).
Si la population est en équilibre alors nous pouvons obtenir une estimation de q en passant par q
2
. Alors la fréquence de l'allèle
dominant est : p = 1 – q ou p = 1 - √q
2
2. Locus autosomiques bialléliques ( a llèles autosomiques codominants)
En présence d'allèles codominants dans un système à deux allèles, chaque génotype a un phénotype distinct. Les nombres de
chaque allèle dans les conditions homozygotes et hétérozygotes peuvent être comptés dans un échantillon d'individus de la
population et exprimés en pourcentage du nombre total d'allèles dans l'échantillon.
Si l'échantillon est représentatif de la population totale alors nous pouvons obtenir une estimation des fréquences alléliques
présentes dans le pool de gènes.
B. Applications dans les populations humaines
Dans l'espèce humaine, la génétique des populations (et entre autres la loi de Hardy-Weinberg) est utilisée par les études
médicales ou anthropologiques. Si l'on considère par exemple une maladie génétique rare et sévère. Récemment l'évolution des
traitements a permis aux patients de survivre et d'arriver à l'âge adulte. Ils sont donc en capacité de se reproduire et de transmettre
l'allèle délétère à leurs enfants. On peut donc se demander comment l'évolution médicale va modifier les fréquences alléliques dans
la population générale et quelles seront les conséquences de ces modifications sur la fréquence de la maladie dans X générations.
D'autres applications classiques portent sur :
- le rapport coût / bénéfices dans le cadre de la mise en place d'un test de dépistage d'une affection génétique en calculant au
préalable la fréquence de la maladie concernée dans la population ;
- l'évaluation de la fréquence des hétérozygotes dans la population générale pour des maladies autosomiques récessives.
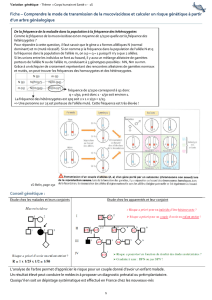
1. Calcul de la fréquence des hétérozygotes
La loi de Hardy-Weinberg permet d'estimer la fréquence des hétérozygotes dans une population. La fréquence d'un caractère
récessif peut être facilement déterminée en comptant les individus exprimant celui-ci dans un échantillon de la population. A l'aide
de cette information et de la loi de Hardy-Weinberg, on peut alors calculer les fréquences alléliques et génotypiques.
La mucoviscidose, caractère autosomique récessif, a une incidence de 1/2500 = 0,0004 dans les populations originaires du nord de
l'Europe. Les individus atteints de cette maladie sont faciles à dépister dans la population grâce aux symptômes. Comme il s'agit
d'un caractère récessif, les individus atteints de mucoviscidose doivent être homozygotes. Leur fréquence dans la population est
représentée par q
2
en supposant que les croisements aient eu lieu au hasard à la génération précédente.
La fréquence de l'allèle récessif dans la population est alors : q = √q
2
= √0,0004 = 0,02, comme p = q = 1 alors la valeur de p est : p
= 1 – q = 1 – 0,02 = 0,98. Dans l'équation de Hardy-Weinberg, la fréquence des hétérozygotes est 2pq. Alors, 2pq = 2(0,98)(0,02) =
0,04 ou 4 % ou 1/25.
Ainsi la proportion d'hétérozygotes pour l'allèle de la mucoviscidose dans la population est relativement importante alors que la
fréquence des homozygotes récessifs est seulement de 0,04 %.
En général dans un système à deux allèles, les fréquences des trois génotypes peuvent être estimées à partir du moment où les
hypothèses de Hardy-Weinberg sont posées et une des deux fréquences alléliques est connue. La relation entre génotype et
fréquence allélique est montrée sur la figure 5.
Il est important de noter que les hétérozygotes augmentent rapidement dans la population quand les valeurs de p et q s'éloignent de
0 et 1. Ces observations confirment notre conclusion selon laquelle lorsqu'un caractère comme la mucoviscidose est rare, la
majorité des individus qui portent l'allèle sont hétérozygotes. Dans les populations pour lesquelles les fréquences de p et q sont
comprises entre 0,37 et 0,67, les hétérozygotes sont trouvés en plus grande proportion que chacun des homozygotes.
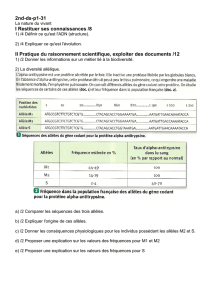
2. Calcul de fréquences pour des allèles multiples
On trouve assez régulièrement plus de deux allèles à un locus donné dans une population. Les groupes sanguins chez l'Homme en
sont un exemple. Le locus I (iso-agglutinine) a trois allèles I
A
, I
B
et I
O
, aboutissant à six génotypes possibles (I
A
I
A
, I
B
I
B
, I
O
I
O
, I
A
I
B
, I
A
I
O
,
I
B
I
O
). Il est à noter que dans ce cas I
A
et I
B
sont des allèles codominants et sont tous les deux dominants par rapport à l'allèle I
O
. Le
résultat de ces observations est que les homozygotes I
A
I
A
et les hétérozygotes I
A
I
O
sont indiscernables par leur phénotype. Il en est
de même pour les individus I
B
I
B
et I
B
I
O
. L'analyse du phénotype ne permet donc de distinguer que 4 combinaisons. En ajoutant une
autre variable à l'équation de Hardy-Weinberg, on peut calculer les fréquences génotypiques et alléliques pour cet exemple
impliquant trois allèles. Soit p, q et r représentant les fréquence alléliques de I
A
, I
B
et I
O
respectivement. La formule devient :
p + q + r = 1.
Les fréquences génotypiques étant données par :
(p + q + r)
2
= p
2
+ 2pq + 2pr + q
2
+ 2qr + r
2
= 1
Si on connaît les fréquences des groupes sanguins dans une population, il est possible de déterminer les fréquences des trois
allèles du système ABO. Par exemple, dans une population échantillonnée, les fréquences des différents types de groupe sanguin
sont 0,53 ; 0,13 ; 0,26 pour les groupes A, B et O respectivement. Ainsi,
r
2
= 0,26 ; donc r = √0,26 ; soit r = 0,51
En utilisant r, on peut ensuite estimer les fréquences des allèles I
A
et I
B
. L'allèle I
A
est présent dans deux génotypes I
A
I
A
et I
A
I
O
conduisant au même phénotype. La fréquence du génotype I
A
I
A
est représentée par p
2
et celle du génotype I
A
I
O
par 2pr.
Les fréquences combinées des types sanguins A et O sont données par :
p
2
+ 2pr + r
2
= 0,53 + 0,26
Si on met en facteur la partie gauche de l'équation et que l'on fait la somme des termes de droite, on obtient :
(p + r)
2
= 0,79 ; soit p + r = √0,79 ; d'où p = 0,89 – r ; donc p = 0,89 – 0,51 = 0,38

Ayant estimé p et r, les fréquences des allèles I
A
et I
O
, nous pouvons maintenant estimer la fréquence de l'allèle I
B
:
On sait que p + q + r = 1 ; donc q = 1 – p – r = 1 – 0,38 – 0,51 = 0,11
Les fréquences phénotypiques et génotypiques de cette population sont résumées dans le tableau de la figure 6.
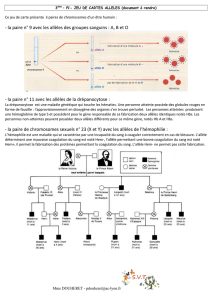
3. Calcul des fréquences pour les caractères liés au sexe
La loi de Hardy-Weinberg peut être utilisée pour calculer les fréquences alléliques et génotypiques de caractères liés au sexe, mais
il faut se rappeler que dans les systèmes de détermination du sexe de type XY, le sexe homogamétique (XX) aura deux copies d'un
allèle porté par l'X alors que le sexe hétérogamétique n'en aura qu'une. Ainsi, pour les mammifères, chez qui les femelles sont XX et
les mâles XY, la fréquence de l'allèle lié à l'X dans le pool de gènes et la fréquence des mâles exprimant ces caractères liés à l'X
seront les mêmes. Comme chaque mâle possède seulement un allèle lié au sexe, la fréquence d'un caractère lié au sexe parmi les
mâles est une mesure directe de la fréquence allélique de la population, en considérant que les fréquences alléliques ainsi
déterminées sont représentatives de celles des femelles aussi. La probabilité pour qu'une femelle ait le même allèle sur ses deux
chromosomes sera q
2
, où q est la fréquence de cet allèle.
Prenons comme exemple le cas de l'allèle récessif présent sur un locus lié au sexe et responsable du daltonisme. Cette maladie
affecte 8 % des hommes. La fréquence de l'allèle responsable du daltonisme est donc de 0,08. Ceci signifie que 8 % des
chromosomes X de la population portent cet allèle. Les 92 % restants portent l'allèle dominant. Si on fait l'hypothèse que p est la
fréquence de l'allèle normal et q la fréquence de l'allèle responsable du daltonisme, alors p = 0,92 et q = 0,08. La fréquence des
femmes exprimant cette maladie (avec deux chromosomes X portant l'allèle responsable du daltonisme) est q
2
= (0,08)
2
= 0,064 et
la fréquence des femmes porteuses saines est 2pq = 2(0,08)(0,92) = 0,147. Cela signifie que 14,7% des femmes portent un allèle
responsable du daltonisme et peuvent le transmettre à leur enfant même si elles sont de phénotype normal.
IV. SELECTION NATURELLE ET VARIATIONS DE FREQUENCES ALLELIQUES
Nous avons vu que la loi de Hardy-Weinberg permet d'estimer les fréquences alléliques et génotypiques pour un locus donné dans
des populations pour lesquelles de croisement au hasard, d'absence de sélection et d'absence de mutation sont valables. En réalité,
il est bien difficile de trouver des populations naturelles pour lesquelles toutes ces hypothèses soient valables pour l'ensemble des
gènes. Dans la nature, les populations sont dynamiques et les changements d'effectifs et de pool de gènes sont fréquents. La loi de
Hardy-Weinberg permet également d'analyser les populations qui diffèrent de la population idéale.
A. La sélection naturelle
L'une des hypothèses de la loi de Hardy-Weinberg est que les individus de tous génotypes ont les mêmes taux de survie et des
fécondités équivalentes. Si l'une de ces conditions n'est pas respectées, les fréquences alléliques ne sont pas conservées d'une
génération à la suivante. Pour expliquer ceci, imaginons une population de 100 individus dans laquelle la fréquence de l'allèle A est
de 0,5 et celle de l'allèle a est de 0,5. En émettant l'hypothèse qu'à la génération précédente les individus se sont croisés au hasard,
on doit alors observer chez les zygotes de la génération présente les fréquences génotypiques suivantes : (0,5)
2
= 0,25 pour AA,
2(0,5)(0,5) = 0,5 pour Aa et (0,5)
2
= 0,25 pour aa. Notre population étant représentée par 100 individus, nous avons 25 individus AA,
50 individus Aa et 25 individus aa.
Supposons maintenant que les individus des différents génotypes aient des taux de survie différents : les 25 individus de génotype
AA, 90 % soit 45 des 50 individus Aa et 80 % soit 20 des 25 individus aa parviennent à l'âge de la reproduction. Lorsque les
survivants se reproduisent, chacun d'eux contribue à fournir deux gamètes au nouveau pool de gènes, ce qui donne 2(25) + 2(45) +
2(20) = 180 gamètes. Quelles sont alors les fréquences alléliques dans la population des survivants ?
Nous avons 50 gamètes A provenant des 25 individus AA et 45 provenant des individus Aa, la fréquence de l'allèle A est alors (50 +
45)/180 = 0,53. Nous avons 45 allèles a provenant des individus Aa et 40 provenant des individus aa, la fréquence de l'allèle a est
donc : (45 + 40)/180 = 0,47. Les fréquences alléliques diffèrent donc des fréquences initiales. L'allèle A a vu sa fréquence
augmenter, alors que la fréquence de l'allèle a a diminué. La différence de taux de survie ou de fécondité (ou les deux) entre les
différents génotypes est appelée sélection naturelle. La sélection naturelle est la principale force qui fait varier les fréquences
alléliques dans les populations à grand effectif et est l'un des plus importants facteurs de changements évolutifs.
B. La notion de valeur sélective
La sélection se produit lorsque des individus avec un génotype particulier acquièrent un certain avantage dans la survie ou la
fécondité par rapport aux autres génotypes. Cependant, la sélection peut varier de moins de 1 % à 100 % dans le cas d'un gène
létal.
Dans l'exemple précédent, la sélection était forte. Une sélection faible peut s'appliquer sous la forme d'une faible différence de
survie ou de fécondité entre les génotypes. Cette différence peut ne représenter que la fraction d'1 %. Les avantages en termes de
survie et de fécondité se traduisent immédiatement par une augmentation de leur contribution génétique dans les générations
futures. La contribution d'un génotype à la formation de la génération suivante est appelée valeur sélective ou fitness. Ainsi, les
génotypes associés à de fortes fécondités sont dits avoir de fortes fitness, alors que les génotypes associés à de faibles fécondités
ont des faibles valeurs sélectives. L'analyse de Hardy-Weinberg nous permet également d'examiner les valeurs sélectives. Par
convention, les généticiens utilisent le signe ω pour représenter les valeurs sélectives. Ainsi, ω
AA
représente la valeur sélective
relative du génotype AA, ω
Aa
celle du génotype Aa et enfin ω
aa
celle du génotype aa. Attribuer par exemple ω
AA
= 1 ; ω
Aa
= 0,9 et
ω
aa
= 0,8 signifie que tous les individus AA, 90 % des individus Aa et 80 % des individus aa survivent, comme dans le cas
précédent. Considérons une sélection contre un allèle délétère, avec ω
AA
= 1 ; ω
Aa
= 1 et ω
aa
= 0. Ces fitness décrivent une
situation dans laquelle l'allèle a est un allèle létal. Un individu homozygote récessif meurt sans laisser de descendance. La
fréquence de l'allèle a va donc décroître au cours du temps. La diminution de la fréquence de l'allèle a est définie par l'équation
suivante : q
G
= q
0
/ (1 + gq
0
)
où q
G
est la fréquence de l'allèle a à la génération g, q
0
est la fréquence initiale et g est le nombre de générations.

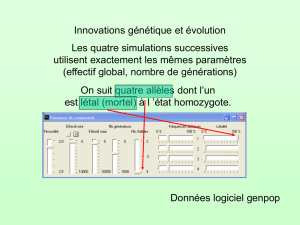
V. DERIVE GENETIQUE ET VARIATIONS ALEATOIRES DE FREQUENCE
La dérive génétique se produit lorsque le nombre d'individus reproducteurs est trop petit pour permettre à tous les allèles constituant
le pool de gènes de passer à la génération suivante, en conservant leur fréquences. La dérive est définie comme le changement de
fréquences alléliques dues à l'échantillonnage au hasard des gamètes.
Pour visualiser ceci, imaginons une population diploïde à reproduction sexuée composée de 25 individus mâles et de 25 individus
femelles. Même si les individus de la population se reproduisent comme 25 couples séparés (ce qui est improbable dans une
population réelle) pour former 25 descendants, le nombre de gamètes formant le pool de gènes à la génération suivante sera
seulement de 50. Il est fortement improbable qu'un si faible nombre de gamètes reflète exactement la structure génétique de la
population parentale. Par conséquent, les allèles individuels peuvent être sur- ou sous-représentés dans le pool de gamètes, ce qui
entraîne un changement aléatoire des fréquences d'une génération à la suivante.
Si on considère un seul locus avec deux allèles A et a, la conséquence de la dérive génétique peut être éventuellement la perte d'un
des deux allèles et la fixation de l'autre, en d'autres termes, il devient l'unique représentant de ce gène présent dans le pool de
gènes de la population. Une corrélation simple décrit la probabilité de fixation ou de perte d'un allèle. La probabilité pour qu'un allèle
soit fixé par dérive est égale à sa fréquence initiale dans la population. Ainsi, si p = f(A) = 0,8, la probabilité que A soit fixé est de 0,8
soit 80 % et la probabilité que A soit perdu par dérive est (1 – 0,8) = 0,2 soit 20 %.
1
/
5
100%