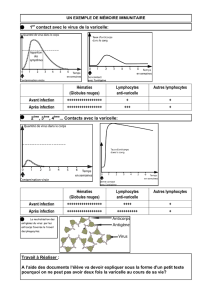
Recommandations suisses pour la prise en charge des infections

Introduction
Ce document s’adresseàdesmédecinsprati-
ciensquitraitentdespatients avecdesinfections
duesà VZV.Ces recommandations reflètentles
connaissancesactuellesainsi que lesparticulari-
tésde lapharmacopée suisse. Nous avonspon-
déré lesniveaux de preuveconcernantlesobser-
vationsimportantes sur la biologie,la clinique et
le traitementdesinfectionsà VZV, ainsi que les
niveaux de recommandation selon une codifica-
tion généralementadmise (tab. 1 p ).
Virus de la varicelle-zoster:
virologie et pathogenèse
Levirus de lavaricelle-zoster(VZV) est un gros
virus à DNA, de lasous-famille desalpha-herpes
virinae[1,2].Après une réplication locale aulieu
d’inoculation,il dissémine par voie hématogène
àlapeauoùil cause l’éruption typique de lavari-
celle. De là, il infecte les terminaisonsnerveuses
sensoriellesintraépithélialeset,parle flux axonal
rétrograde,vaétablir une infection latente dans
lesneuronesde l’ensemble desganglions senso-
riels rachidiensetcrâniens.Durantcette latence,
qui duretoute lavie,seulsquelquesgènesdu
virus sontexprimés.La réactivation de VZV ré-
sulte probablementd’une baisse des réponses
immunitairescontreVZV.Durantcetteréactiva-
tion,le ganglion sensoriel atteint subit une né-
crose hémorragique qui laisse des séquellesdans
les voies sensorielles.Cesanomaliesanatomi-
ques, ainsi que desanomaliesfonctionnellesin-
duitesparladouleur aiguërendentprobable-
mentcompte de lapersistance de ladouleur au
delàde laphaseaiguë (algie postzostérienne).
VZV possède une thymidine-kinase et une DNA
polymérase quirendentcompte de sasuscepti-
bilitéaux analoguesde nucléosides.
Lesmédicaments àdisposition pour le traitement
desinfectionsà VZV comprennentl’aciclovir
(ACV),le valaciclovir(VACV),le famciclovir(FCV)
etla brivudine (BVD). Ils sontchoisisen tenant
compte de leur domaine d’indications reconnues
etde leurs contre-indications(tab.3et5). Encas
de développementde résistanceaux analogues
de nucléoside ci-dessus,le foscarnetoffreune
option de seconde ligne.
Varicelle
Epidémiologie
VZV a une répartition mondiale. La varicelle,ex-
pression de laprimo-infection parVZV, est très
contagieuse. Encasd’exposition,96% desindi-
vidus susceptibles s’infectent.Sous noslatitudes,
90–95% desindividus s’infectentlors d’épidé-
Ces recommandations sont adoptées par les Sociétés Suisses
de Dermatologie et Vénéréologie, de Gynécologie et Obsté-
trique, d’Ophtalmologie, de Pédiatrie, d’Hémato-Oncologie et
de Médecine Générale.
Soutenu par une bourse pour l’éducation de GlaxoSmithKline
Suisse.
recommandations Forum Med Suisse 2007;7:895–905 895
Recommandations suisses pour la prise en charge
des infections dues au virus de la varicelle-zoster
P. Meylana, W. Kempfb , S. Gerberc , C. Aebid , R. Agostie , S. Büchnerf , B. Coradig , J. Garwegh , H.H. Hirschi ,
C. Kindj , U. Lauperk , S. Lautenschlagerl , P. Reusserm , C. Ruefn , W. Wunderlio , et D. Nadalp , pour le Swiss
Herpes Management Forum
aInstitut de Microbiologie, Service des Maladies Infectieuses, CHUV Lausanne, bDermatologische Klinik, Universitätsspital Zürich und Dermato-
logische Praxis am Schaffhauserplatz, Zürich, cService de Gynécologie et Obstétrique, CHUV Lausanne, dMedizinische Universitäts-Kinderklinik,
Inselspital Bern, eNeurologie, Kopfwehzentrum Hirslanden, Zürich, fDermatologie, Universitätsspital Basel und Dermatologische Praxis, Basel,
gB. Coradi, Allgemeinmedizin, Praxisgemeinschaft Affoltern, Zürich, hJ. Garweg, Augenklinik, Inselspital Bern, iInstitut für Medizinische Mikrobio-
logie, Universität Basel und Klinik für Infektiologie und Spitalhygiene, Universitätsspital Basel, jOstschweizerisches Kinderspital, St. Gallen,
kGynäkologie und Geburtshilfe, Universitätsspital Zürich, lDermatologisches Ambulatorium Triemli, Zürich, mMédecine Interne, Hôpital du Jura,
Delémont/Porrentruy, nKlinik für Infektionskrankheiten und Spitalhygiene, Universitätsspital Zürich, oLaboratoire Central de Virologie, HUG,
Genève,pInfektiologie und Spitalhygiene, Universitäts-Kinderklinik Zürich
Quintessence
Lesinfectionsduesau virus de lavaricelle-zoster(VZV)sont souventassociées
àune morbiditésubstantielle. Leur diagnosticetprise en charge sontcomplexes,
en particulierchezl’hôte immunocompromisetdurantlagrossesse. Lespré-
sentes recommandationsontété établiespar un groupe multidisciplinaire
de spécialistesetadoptéesparde nombreuses sociétésmédicales suissesim-
pliquéesdanslaprise en charge médicale de telspatients (voirappendice). Le
but de cesdirectivesconsisteà améliorerles soinsaux patients concernés,et
àréduire l’incidence descomplications.
Summary
Infections withvaricellazoster virus (VZV)arecommon viral infectionsasso-
ciated withsignificantmorbidity.Diagnosisand managementarecomplex,par-
ticularlyin immunocompromised patients and during pregnancy.The present
recommendationshavebeen established byamultidisciplinary panel of spe-
cialists and endorsed bynumerous Swiss medicalsocietiesinvolved in the med-
icalcare of such patients (Appendix). The aim is to improvethe care of affected
patients and toreducecomplications.
895-905Kempf259_f.qxp:Layout 1 19.10.2007 13:49 UhrSeite 895

miesen fin d’hiverouauprintemps,en vaste
majoritéavantl’âge de 10ans.Moinsde 5% des
individus s’infectentaprèsl’âge de 15 ans[3](II)
tandisque laprévalence danslespays tropicaux
ou subtropicaux est plus basse qu’en Europe ou
aux Etats-Unis[4,5].Parconséquent,lesimmi-
grants de ces régions représentent un groupe à
risque plus élevé de varicelle chezl’adulte. Le
virus est excrété dansles sécrétions respiratoi-
res,etla contagion se produitpar voie aérogène
voire mucocutanée parcontactdirectavecle
contenudes vésicules.Lesportesd’entrée sont
lasphèreORL etlesconjonctives.
Varicelle chez l’enfant
Suiteà10–21 jours d’incubation,lamoitié des
enfants présententdesprodromes(fièvre <39 °C,
malaise, céphaléesetdouleurs abdominales) qui
précèdentl’exanthème de 24–72 heures.Ce der-
nier se manifeste d’abord pardesmaculesetpa-
pules sur latête etle troncquisetransforment
rapidementen vésiculesprurigineusesetpustu-
les.Ontrouvetypiquementdeslésionsd’âge dif-
férent simultanément sur une partie donnée du
corps.Des vésiculesoudes ulcérations sontfré-
quemmentobservéesauniveaumuqueux.De
nouvelleslésionscontinuentd’apparaître pen-
dant1–7jours,maisle plus souvent 3–6jours.
Cette durée d’apparition, ainsi que ladurée de la
fièvre,sontplus longueschezlesenfants infectés
pardescontacts intra-familiaux [6].Lescas secon-
daireset tertiairesdanslamême maisonnée sont
àrisque de varicelle plus sévère etpourraientbé-
néficierd’untraitementantiviral[7](B).
La sévérité de lamaladie augmenteavecl’âge.
Deslésionscutanéespréexistantescomme par
exemple un eczémafavorisent une extension ra-
pide deslésions[8].La formation de cicatrices
importantesest extrêmement rare. Parcontre,
une dépigmentation peut persisterquelques se-
maines.Letaux d’hospitalisation est de l’ordre
de 9/10000 casde varicelle [9].Descas sévères,
voire mortels,sontobservéschezdesenfants
recevant untraitement systémique ouintranasal
de stéroïdes,en particulierlorsque le traitement
est administré durantl’incubation de lavaricelle
[10,11].Descasde récidive de varicelle ontété
décrits,mais sont très rares[12].Lescomplica-
tionsde lavaricelle chezl’enfant sont recensées
dansle tableau2p .Leredoutable syndrome de
Reye[13]n’est plus qu’exceptionnellementob-
servé depuisqu’on prohibe les salicylésdurant
lavaricelle.
Letraitementde lavaricelle chezl’enfantimmu-
nocompétentne requiert généralementpasd’an-
tiviraux.Danscette indication,l’aciclovir raccour-
citlégèrementlamaladie (I)[6,14].Chezl’enfant
immunocompromis,l’acyclovirintraveineux est
indiqué pour limiterleslésionscutanéesetles
disséminations viscérales(tab.3p ). Levalaci-
clovirpar voie orale,un promédicamentde l’aci-
cloviràla biodisponibilitéaméliorée,produitdes
taux sériquesd’aciclovircomparablesàl’aciclovir
intraveineux [15]maisen raison de donnéeslimi-
téesne peut être prescritqu’àdesenfants peu
sévèrementatteints (C). Lesenfants devraientêtre
exclus descrèches,jardinsd’enfants etécolesjus-
qu’à ce quetoutesleslésions soientcouvertesde
croûtes(C). Lescontacts séronégatifsimmuno-
déficients ouadultesdevraientêtre identifiés(C).
Varicelle chez l’adulte
La varicelle àl’âge adultes’accompagne d’un
prodrome souventplus marqué[8].Lerisque de
complications sérieuses,voire mortellescroît
avecl’âge (tab.2). La mortalitéchezlesadultes
est de 17/100000 [16]etest avant tout liée àla
pneumonie varicelleuse[17](II). Cette dernière
débute entre 1 et 6 jours aprèsle début de l’érup-
tion et se manifeste parde lafièvre,toux,dys-
pnée,douleurs thoraciqueset tachypnée. En
casde dyspnée,une radiographie du thoraxet
une hospitalisation sont recommandées(IV, C).
La mortalité de lapneumonie varicelleusechez
l’adulte parailleurs sain atteint10%[18](II).
L’encéphalite (incidence de 1–2/10000) est une
complication neurologiquerare de lavaricelle,
quise manifeste durantles 7 premiers jours du
rash parde lafièvre,descéphalées,de la confu-
sion,uncomportementbizarre,de laléthargie,
un méningisme etdescrisesconvulsives[19]et
est associée àune mortalité de 5–10%[20](II).
Chezl’adulte,untraitementantiviral précoce
est recommandé en casde varicelle dansles
24 heuresquisuiventl’apparition du rash[2,21]
(tab.3) (C). Chezl’adulte immunocompétent sus-
ceptible (séronégatif),lavaricelle peut être pré-
venue par une vaccination post-exposition,sicette
dernière est administrée dansles 24 heures sui-
vants le contage (tab.3).
Varicelle chez l’hôte immunodéficient
L’évolution de lavaricelle chezl’hôte immuno-
déficientest marquée par une sévérité et une fré-
quence élevée de complications[22–24].Il existe
unrisque élevé d’atteinte d’organes suiteàladis-
recommandations Forum Med Suisse 2007;7:895–905 896
Tableau 1. Niveaux de preuve et de recommandation.
Abréviation Type d’étude
IEtude contrôlée et randomisée (ou revue systématique de telles études)
II Etude contrôlée mais non randomisée
III Etude de cohorte prospective
IV Etude de cohorte rétrospective ou étude cas-témoin
VEtude de série de cas, opinion d’experts
Abréviation Niveau de preuve
APreuves solides à l’appui de la recommandation (en général, niveau I)
BPreuves acceptables (en général, niveau II ou III)
CPreuves inadéquates (en général niveau IV ou V). Une recommandation
peut être faite sur d’autres bases
DPreuves acceptables à l’encontre de la recommandation
(en général, niveau II ou III)
EPreuves solides à l’encontre de la recommandation (en général, niveau I)
895-905Kempf259_f.qxp:Layout 1 19.10.2007 13:49 UhrSeite 896

sémination systémique,quis’accompagne d’une
morbidité etd’une mortalité élevées[23–26](IV).
Lescomplicationsfréquentes sontlapneumonie,
quise produitchez untiers desenfants leucémi-
quesprésentant une varicelle [25](IV),une attein-
te du système nerveux central (méningoencépha-
lite, ataxie cérébelleuse,myélite),une atteinte du
système nerveux périphérique (syndrome de
Guillain-Barré),voireune hépatite ou une atteinte
hématologiqueavecthrombocytopénie [22].Le
diagnosticest généralementbasésur la clinique.
Le diagnosticdesatteintes viscérales requiert
parcontre desbiopsiesavecmise en évidence du
virus parculture,immunohistochimie ouPCR.Le
diagnosticde l’atteinte peut être posé de manière
non invasive danslapneumonie oul’atteinte du
SNC en analysant respectivementle liquide de la-
vage broncho-alvéolaire oule liquide céphalo-
rachidien.
Une prophylaxie desinfectionsà VZV est indi-
quée chezlespatients immunodéficients [22].
Enraison de lahautecontagiosité,lespatients
immunodéficients et séronégatifsdoiventêtre
protégésdespatients avecvaricelle. Il faut noter
quecesderniers commencentàêtrecontagieux
déjàdeux jours avantle début de l’exanthème.
Lorsqu’un patientimmunodéficientet séronéga-
tif est néanmoinsexposé,il est recommandé de
luiadministrerdesimmunoglubulineshyperim-
munescontreVZV le plus tôtpossible,en prin-
cipe auplus tard 96heuresaprèsl’exposition [2]
(C). Unbut importantprincipal du traitement
antiviral desinfectionsà VZV chezl’hôte immu-
nodéficientest de prévenir une dissémination
viscérale [27].Il est conseillé danscescasde
consulter unspécialiste. L’acyclovirintraveineux
est le traitement standard pour lespatients pro-
fondémentimmunodéficients avecvaricelle ou
zoster(e.g. aprèsgreffe de cellules soucheshéma-
topoïétiquesallogénique oulors de traitementde
rejetchez untransplanté d’organe solide [2,26,
27](IA). Chezlespatients moinsimmunodéfi-
recommandations Forum Med Suisse 2007;7:895–905 897
Tableau 2. Complications de la varicelle.
Complication Commentaire
Chez l’enfant
Infections bactériennes secondaires Staphylococcus aureus et Streptococcus pyogenes sont
les agents étiologiques les plus fréquents de cellulite,
plus rarement lymphadénite ou abcès sous-cutané [1]
fasciite nécrosante ou Toxic shock syndrom causé par des
souches de S. pyogenes productrices d’exotoxin-A [2, 3]
Complications neurologiques cause n° 2 d’hospitalisation [4–6]:
cérebellite, encéphalite, ataxie cérebelleuse
très rare: myélite transverse, syndrome de Guillain-Barré
Autres complications très rare: hépatite, thrombocytopénie, néphrite, arthrite,
myocardite, péricardite, pancréatite et orchite
Chez l’adulte
Pneumonie varicelleuse symptomes chez seulement 30% des personnes
atteintes! Mortalité: 10%
Encéphalite incidence 1–2/10000; mortalité 5–10%
Myélite
Formation de cicatrices
Durant la grossesse
Femme enceinte
Pneumonie varicelleuse incidence 16%; surtout dans le dernier trimestre
mortalité 20–40%
Foetus
Semaine 1–20 de grossesse.
Syndrome de varicelle foetale risque 0,4% (semaine 1–13)
risque 2% (semaine 14–20)
Après la 20esemaine de grossesse
Varicelle congénitale apparition entre les jours 5–15 du post partum
risque: mortalité 30%
Références
1Aebi C, Ahmed A, Ramilo O. Bacterial complications of primary varicella in children. Clin Infect Dis. 1996;23:698–705
2Laupland KB, Davies HD, Low DE, Schwartz B, Green K, McGeer A. Invasive group A streptococcal disease in children and
association with varicella-zoster virus infection. Ontario Group A Streptococcal Study Group. Pediatric. 2000;105:E60.
3Nadal D, Lauener RP, Braegger CB, et al. T cell activation and cytokine release in streptococcal toxic shock-like
syndrome. Journal of Pediatric. 1993;122:727-9.
4Arvin A. Varicella-zoster virus. In: Long S, Pickering L, Prober CG, eds. Principles and Practice of Pediatric Infectious
Diseases. 2nd ed. New York: Churchill Livingstone; 2003:1041–50.
5Guess HA, Broughton DD, Melton LJ, LT. Population-based studies of varicella complications. Pediatric. 1986;78:723–7.
6Peters AC, Versteeg J, Lindeman J, Bots GT. Varicella and acute cerebellar ataxia. Arch Neurol. 1978;35:769–71.
895-905Kempf259_f.qxp:Layout 1 19.10.2007 13:49 UhrSeite 897

recommandations Forum Med Suisse 2007;7:895–905 898
Tableau 3. Prophylaxie post-exposition et traitement médicamenteux de la varicelle.
Indication Médicament Dosage Commentaire
Varicelle chez l’enfant (jusqu’à 12 ans)
Prophylaxie
Chez l’enfant immunocompétent: non recommandé
Chez l’enfant immunodéficient: VZV-Immunglobuline 12,5–25 I.U. par kg de poids corporel i.v. une dose <48 h après l’exposition mais
Varicelle pas plus de 96 h après l’exposition
IVIG 0,4 g /kg P.C. une dose (au lieu de VZV-IG)
vaccination post-exposition
Traitement
Chez l’enfant immunocompétent: traitement symptomatique local badigeon désinfectant
traitement systémique optionnel Aciclovir p.o. –100 mg/kg/j
pendant 5–10 jours
Chez l’enfant immunodéficient: traitement systémique Aciclovir 3x20 mg/kg/j i.v.
pendant 5–10 jours
Varicelle chez l’adulte immunocompétent (durant les 24 premières heures)
Prophylaxie vaccination post-exposition
Traitement Aciclovir 5 x 800 mg par jour p.o. 5–10 jours
3 x 10 mg/kg /jours i.v. 5–10 jours
lors d’atteinte sévère
Valaciclovir 3 x1 g par jour p.o. 7–10 jours
Famciclovir 3 x 500 mg par jour p.o. 7–10 jours
Le traitement de la varicelle comprend, mis à part les antiviraux, la prescription d’analgésiques (aspirine contre indiquée chez l’enfant de moins de 11 ans
en raison du risque de syndrome de Reye) et d’un traitement topique par badigeon désinfectant (crème de sulfadiazine d’argent, badigeon rose).
Varicelle chez l’adulte immunodéficient (durant les 24 premières heures)
Prophylaxie post-exposition VZV-Immunglobuline chez le
patient immunodéficient séro-
négatif pour VZV dans les 4 jours
suivant l’exposition.
Traitement Aciclovir 3 x 500 mg/m2 ou 10 mg/kg P.C. par jour i.v.
pour 7–14 jours
Valaciclovir 3 x1 g par jour p.o. 7 jours
Famciclovir 3 x 500 mg par jour p.o. 7 jours
Varicelle durant la grossesse
Prophylaxie post-exposition VZV-IG ou IVIG 125 U / 10 kg P.C. (max. 625 U)
chez a femme enceinte resp. IVIG 0,4ml/kg i.v.dans les
séronégative 72–96 heures après l’exposition
Traitement Traitement symptomatique local
Traitement antiviral Aciclovir 3 x 10 mg/kg P.C./jour i.v. 7 jours lors d’atteinte sévère ou de complica-
tions, voire dans tous les cas (C)
Varicelle chez le nouveau-né
Prophylaxie
Indications pour VZIG [59]:
Administration de VZV-IG immédiatement après la naissance ou l’exposition post-natale:
–nouveau-né de mère dont l’exanthème s’est produit entre 5 (à 7) jours avant resp. 2 jours après la naissance (B)
–prématurés et nouveau-nés malades avec exposition nosocomiale à VZV (contact direct ou au moins une heure passée dans le même local que la personne
infectieuse) et dont la mère n’est pas immune contre VZV (C)
–prématurés de moins de 28 semaines ou moins de 1000g de poids de naissance avec une exposition nosocomiale, indépendamment du sérostatus
maternel (C).
Indication débattue:
–nouveau-né à terme, sain, de mère non immune avec exposition VZV post-natale (en particulier lors d’exposition à domicile d’un frère ou
d’une sœur infectieuse
Pas d’indication:
–exposition brève à la maternité.
Traitement
Lors de symptomes systémiques Acyclovir i.v. 3 x 20 mg/kg P.C./jour i.v.
ou d’exanthème sévère:
895-905Kempf259_f.qxp:Layout 1 19.10.2007 13:49 UhrSeite 898

cients eten l’absence d’évidence d’atteinteviscé-
rale,une dose élevée orale de valaciclovir,d’aci-
cloviroude famiclovirest possible,de même que
chezlespatients sévèrementatteints, après répon-
seau traitementintraveineux [2,28](IB)(tab.3).
Varicelle et grossesse
Une infection àvaricelle pendantlagrossesse
représenteunrisque maternel etimplique lapos-
sibilité d’une transmission verticale transpla-
centaire (fig.1 x ).
Bien que probablement sous diagnostiquée,l’in-
cidence de lavaricelle chez une femme enceinte
est évaluée à1/2000 grossesses[29,30](III). La
varicelle peut prendreun décours plus sévère
chezlafemme enceinte. La complication laplus
fréquente est lapneumopathie varicelleuse[31]
(III),potentiellement sévèreavecle développe-
mentd’unsyndrome de détresserespiratoireaigu
et untaux de mortalité pouvantatteindre20%,
voire 40% en l’absence de traitement[32].Aussi,
devant toutevaricelle,une attention particulière
doitêtre portée sur l’identification précoce d’une
pneumonie notammenten présence d’une vari-
celle sévère etlors d’une atteinte du troisième
trimestre[33,34](B). Malgré l’absence d’une évi-
dence de l’efficacité d’untraitementparacyclovir,
ce dernierpeut être proposé lors de varicelle chez
lafemme enceinte. Parcontreson indication est
reconnue lors de pneumopathie varicelleuse[35,
36](tab.3) (C). L’adjonction d’immunoglobuline
spécifique danscettesituation n’apasdémontré
de bénéfice (B).
Varicelle maternelle avant 20 semaines –
risque fœtal et prise en charge
Misàpart unrisqueaugmenté de fausse-couche
oude mort in utero[37–39](III) on craintl’em-
bryo-fœtopathie de lavaricelle congénitale,quise
caractérise pardeslésionscutanéescicatricielles
(100%),une hypoplasie ouaplasie desmembres
(86%),un petitpoidsde naissance (82%),une at-
teinte oculaire (64%),une atteinte neurologique
(30%) et unretard psychomoteur (50%). Lerisque
global de développercesyndrome est faible,es-
timé à0,7%. etdépend dumomentde laprimo-
infection maternelle (III). Lors d’une infection
entre0et13 semaines,le risque est de 0,4%, alors
qu’il est de 2% entre 13et 20 semaines.Une infec-
tion maternelle ne justifie pas une interruption de
grossessesansdiagnosticprénatal (B). Ce dernier
comprend une identification parPCR du virus VZV
dansle liquide amniotique ,recommandée pour
prédireunsyndrome congénital en casde vari-
celle avantlavingtième semaine,encore quece
point soitcontroversé[40–42](C). Le meilleur
indicesemble être fourni parl’évaluation écho-
graphique, avecuncontrôle mensuel recom-
mandé [43](B). Lors de lamise en évidence d’une
anomalie échographique,lesparents doiventêtre
informés,en particulierconcernantlapossibilité
de lésionscérébralesassociées,et une interrup-
tion de grossesseseradiscutée [44](B).
Encasde contage chez une patienteséronéga-
tive,l’administration d’immunoglobulines spéci-
fiques(VZIG) ouimmunoglobuline polyvalente
(IVIG) est recommandée (B). Cette immunisation
passive doitêtreadministrée idéalementdansles
72 à96heures suivantle contact,mais un effet
bénéfique pourraitêtre observé jusqu’à10jours
suivantl’exposition [38,45].Son effetprotecteur
sur le développementde lafœtopathie varicel-
leuse n’apasété prouvé,maislafréquence de
l’infection fœtale sembleraitdiminuée [41](III).
L’efficacité desdifférents traitements antiviraux,
ycomprisl’aciclovir,n’apasété démontrée dans
le but de prévenir une transmission verticale (III).
Varicelle maternelle à terme ou proche
du terme – risque fœtal et prise en charge
Lors de varicelle maternelle proche du terme,le
cours clinique de l’infection néonatale dépend du
momentde latransmission (intra-utérin oupost-
natal) etde laprésencerespectivementde l’absen-
ce d’anticorps spécifiqueschezlamèreaumoment
de lanaissance[46].La transmission transplacen-
tairesuiteàune virémie maternelle peut résulter
en un inoculum élevé,tandisque l’absence d’an-
ticorps transmisaunouveau-né conduitàuncours
cliniquecomparable à celui d’un individuimmu-
nodéficient.Cesdeux facteurs aggravants sont
réunislorsque l’exanthème se déclarechezlamère
entre 5 (voire7) jours avantjusqu’à2jours après
lanaissance (voirfig. 2x ). Danscettesituation,
l’éruption apparaîtchezle nouveau-né entre 5 et
15 jours aprèslanaissance,etdesmaladiesgraves
sontfréquentesavecune mortalitéatteignant 30%
en l’absence de traitement[47](V). Aucontraire,
lorsque l’exanthème se déclarechezlamère entre
5 et 21 jours avantlanaissance,le pronosticest
favorable [48](III). Parconséquent,il faut tout
faire,en casd’exposition àlavaricelle proche du
terme,pour empêcherlanaissance de se produire
durantcette phase dangereuse entre 5 jours avant
jusqu’àdeux jours aprèslanaissance (C).
recommandations Forum Med Suisse 2007;7:895–905 899
Figure 1
Varicelle et grossesse; risque en fonction de l’âge de la grossesse.
020T
semaines
Risque: Fœtal Maternel Fœtal
Syndrome congénital Pneumonie* Varicelle néonatale
Attitude: Diagnostic prénatal Follow up Timing
accouchement
* La femme enceinte peut développer une pneumonie varicelleuse pendant toute la gros-
sesse, mais le risque augmente après les semaines 18–20 (Alonso AM, J Gynecol Obstet Biol
Reprod. 1999;28:838).
¸˝˛
¸˝˛
¸˝˛
flflfl
895-905Kempf259_f.qxp:Layout 1 19.10.2007 13:49 UhrSeite 899
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%