Maladie d`Alzheimer et immunothérapie : espoir ou

S 638
L’Encéphale, 2006 ;
32 :
638-40, cahier 5
Maladie d’Alzheimer et immunothérapie : espoir ou désillusion ?
B. DUBOIS
(1)
(1) CHU Pitié-Salpêtrière, Paris.
Rewriter I. Fabre.
L’ESPOIR…
La mise au point de modèles expérimentaux de maladie
d’Alzheimer suscite beaucoup d’espoir.
D’une part, des souris transgéniques, après manipula-
tions génétiques, surexpriment le gène codant pour la pro-
téine amyloïde, qui se dépose dans le cerveau des
patients atteints de maladie d’Alzheimer (MA). On en a la
preuve en neuropathologie, avec la mise en évidence de
plaques amyloïdes chez la souris.
D’autre part, Shenk
et al.
(2000) ont injecté le peptide
amyloïde en périphérie, chez la souris. Celle-ci produit des
anticorps qui passent en petites quantités dans le cerveau
et iront peut-être détruire les plaques amyloïdes fabri-
quées. En neuropathologie, le résultat est étonnant. Les
souris n’ont pas de plaques dans le cerveau.
On souhaite répliquer ces travaux chez les patients.
LA DÉSILLUSION…
L’encéphalite sub-aiguë…
Toutefois, l’espoir doit être tempéré. En effet, une
patiente suivie en neurologie, puis en gériatrie, à qui l’on
a injecté le peptide amyloïde, a développé une méningo-
encéphalite immuno-allergique (MEIA), imposant l’arrêt
immédiat du traitement. Le liquide céphalo-rachidien était
inflammatoire et les lésions cérébrales de la substance
blanche prenaient le contraste.
Dans une étude multicentrique de phase II portant sur
370 patients, 300 reçoivent le peptide amyloïde et 70 le
placebo. Dix-huit patients (6 %) ont présenté une MEIA,
dont 6 Français. La MEIA est observée dans la majorité
des cas après la deuxième injection (91 %), et une latence
médiane de 75 jours. Deux tiers des patients récupèrent
(12), un tiers gardent des séquelles (6), dont un patient
des séquelles graves. De plus, les taux d’anticorps A 42
ne sont pas corrélés à la sévérité de la MEIA.
Le développement de l’immunothérapie doit donc être
contrôlé : l’étude initiale est interrompue après la
deuxième injection, au lieu des six prévues. Cependant,
les patients continuent d’être suivis et ont tout de même
bénéficié de deux injections.
RÉSULTATS PRINCIPAUX
Il n’y a pas d’effet significatif des deux vaccinations sur
le paramètre cognitif, critère primaire d’efficacité.
Les volumes cérébraux et hippocampiques des
patients traités diminuent. Cette diminution est inverse-
ment corrélée à la tendance observée dans les tests de
mémoire.
Ce résultat est surprenant. On attendrait plutôt un ralen-
tissement du processus pathologique d’atrophie, en cas
d’effet structurel de la vaccination ; au contraire, il y a une
augmentation de l’atrophie.
Ce résultat inattendu porte à discussion. Traduit-il
l’existence d’une encéphalite infraclinique ou d’une
gliose ? On peut émettre l’hypothèse mécanistique d’une
balance entre les éléments cellulaires, par modification de
densité et résultant de la diminution des plaques. Il y aurait
une sorte de nettoyage des plaques, qui entraînerait une
diminution de volume, donc de densité neuronale ou de
matière, ce qui expliquerait l’augmentation de l’atrophie.
Malgré tout, il faut garder un espoir mesuré vis-à-vis de
l’approche d’immunothérapie, du fait de résultats secon-
daires encourageants.
RÉSULTATS SECONDAIRES
Cliniques
Ces résultats sont rapportés dans les premiers travaux
d’Orgogozo
et al.
(
Neurology
, 2003), puis par McLaurin

L’Encéphale, 2006 ;
32 :
638-40, cahier 5 Maladie d’Alzheimer et immunothérapie : espoir ou désillusion ?
S 639
et al.
(
Alzheimer Dis Assoc Disord
, 2004). Ces derniers
font une analyse secondaire très critiquée d’une trentaine
de patients, extraits de leur population. Dans cet échan-
tillon restreint, les auteurs observent un effet significatif de
la vaccination sur le
Mini-Mental State
(MMS).
Gilman
et al.
(
Neurology
, 2005) montrent une efficacité
significative de la vaccination par rapport au placebo, sur
un critère cognitif composite. Ce critère associe l’
Alzhei-
mer’s Disease Assessment Scale-cognitive subscale
(ADAS cog) et une batterie de tests de mémoire (Wechsler
mémoire, 15 mots de Rey), et d’attention (empans chiffrés
endroit et envers). Le résultat n’est pas significatif sur
l’ADAS cog.
Données post-mortem
Une patiente décédée en phase II précoce d’une étude
de tolérance a été prélevée en post-mortem. La mort ne
serait pas liée aux vaccinations reçues d’après Nicole
et al.
En neuropathologie, on observe l’absence de pla-
ques séniles (PS) dans plusieurs régions corticales. Ces
résultats sont étonnants et indiquent un effet possible de
l’injection.
ÉTUDES EXPÉRIMENTALES
La pharmacogénomique recherche des bio-marqueurs
prédictifs du risque de MEIA. L’expression de gènes impli-
qués dans l’apoptose et les processus pro-inflammatoi-
res, est associée au risque de développer une MEIA.
On pourrait ainsi identifier efficacement, les sujets à ris-
que de développer une MEIA ou une autre complication,
et ceux, répondeurs à la vaccination.
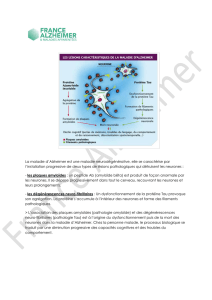
Certaines régions corticales sont dénuées de PS. Sur
des coupes de cerveau de patients atteints de MA ayant
reçu des anticorps, l’immun sérum se fixe sur les PS, mais
pas le sérum pré-vaccination. Le phénomène immunolo-
gique est donc bien spécifique, avec une reconnaissance
par les anticorps des PS amyloïdes. Ceci est confirmé par
le double marquage par un anticorps monoclonal, le 4 G 8,
marqueur des PS.
PERSPECTIVES THÉRAPEUTIQUES :
TROIS PISTES…
Transfert d’immunoglobulines anti-A
Les immunoglobulines anti-A sont directement injec-
tées au sujet, qui ne produit donc pas d’anticorps en
réponse à l’antigène. Certaines vont passer dans le
cerveau : elles détruisent les PS et désagrègent les pep-
tides A.
L’objectif est de mettre au point des molécules antigé-
niques moins puissantes en terme d’effets secondaires,
que le peptide A 42 très immunogène. Les recherches por-
tent sur un épitope réduit, qui aurait le même pouvoir favo-
rable, sans déclencher de réponse immunitaire à cellules
T.
Autres voies d’immunisation :
transfert passif d’anticorps
On obtient une réduction significative des PS amyloïdes
dans le cerveau de l’animal, après injection de l’anticorps :
83 à 91 % selon que l’anticorps est polyclonal ou spécifi-
que. Les complications sont dues à la formation de com-
plexes immuns.
Transfert passif d’épitopes
Un travail récent, publié dans Nature en 2002, montre
que l’épitope 4-10 (6 AA), a la même efficacité que le pep-
tide complet (42 AA), sans déclencher de réponse immu-
nologique. Il inhibe la formation spontanée de fibres, la
cristallisation des peptides A, en présence de sérum A 4-
10. D’une part, il peut donc inhiber la fibrillogénèse et
d’autre part, il peut désagréger les fibres préformées.
CONCLUSION
L’immunothérapie A est extrêmement efficace dans les
modèles animaux de maladie d’Alzheimer.
Les cas post-mortem démontrent des effets compara-
bles sur la pathologie amyloïde chez l’homme. Malheu-
reusement, une méningo-encéphalite immuno-allergique
survient dans 6 % des 300 cas rapportés, avec des
séquelles (2 %), sévères (1 %). L’immunothérapie doit
donc être adaptée afin d’éviter cette complication auto-
immune liée à l’activation des cellules T. Plusieurs pistes
de recherche sont possibles.
Question
(M. Haddou)
L’apprentissage explique-t-il certains résultats cognitifs
positifs après vaccination ?
Réponse
Oui, c’est l’un des biais de ces d’études d’une façon
générale. Mais ce biais est compensé par le fait l’effet
d’apprentissage est présent dans les deux groupes. C’est
la différence d’effet entre groupe traité et groupe placebo,
et non la différence par rapport à la ligne de base que l’on
recherche.
Question
(Professeur J.-P. Olié)
Que sait-on des corrélations entre évolution neuro-
pathologique et évolution comportementale, voire cogni-
tive ?

B. Dubois L’Encéphale, 2006 ;
32 :
638-40, cahier 5
S 640
Réponse
C’est un des points fondamentaux actuels. La meilleure
connaissance de la MA permet d’individualiser des affec-
tions autrefois assimilées à la MA : démence fronto-
temporale, démence sémantique, atrophie corticale
postérieure, dégénérescence corticobasale, aphémie
progressive, démence à Corps de Lewy. On était dans
l’incapacité de faire des corrélations anatomocliniques.
Depuis que ces entités sont démembrées, la MA apparaît
beaucoup plus homogène.
Sur le plan qualitatif, l’expression clinique est assez
bien corrélée aux données de neuropathologie. La mala-
die débute vers l’âge de 40 ans. Les lésions initiales siè-
gent dans les structures temporales internes, notamment
hippocampe et cortex entorhinal. Puis, les lésions pro-
gressent vers les voies limbiques, le cortex frontal, les
aires associatives hétéro-modales et le carrefour pariéto-
temporo-occipital (Braak et Braak).
Parallèlement, le tableau clinique débute par des trou-
bles de mémoire et le syndrome amnésique hippocampi-
que. Puis, apparaissent l’apathie, les troubles du jugement
et du raisonnement, les difficultés de double tâche dans
le traitement de l’information complexe, finalement le syn-
drome aphaso-apraxo-agnosique, avec des troubles du
langage, des praxies et des gnosies.
L’apathie, symptôme relativement précoce, est liée à
la diffusion précoce des lésions vers les régions orbito-
ventrales, les phénomènes délirants et hallucinatoires,
vers les régions postérieures. Les lésions orbitro-ventra-
les s’accompagnent d’une perte progressive de l’insight
et aboutit à une sorte de retrait et d’isolement par rapport
à l’environnement.
Sur le plan quantitatif, les corrélations clinicopathologi-
ques sont assez étroites pour la dégénérescence neuro-
fibrillaire. En revanche, il n’y aucune corrélation entre la
sémiologie clinique et les plaques séniles.
Question
Depuis l’arrêt du protocole, les patients ont-ils bénéficié
d’anti-cholinestérasiques ? Les effets associés de l’immu-
nothérapie et des traitements anti-cholinestérasiques
vont-ils faire l’objet d’une analyse ?
Réponse
Oui, probablement. On aura l’effet conjoint. Il n’est pas
exclu qu’un résultat positif soit le résultat d’une interaction
entre les deux traitements.
Question
Il y a une polémique autour d’une équipe américaine :
la substance amyloïde serait une conséquence protec-
trice éventuelle de la lutte du cerveau contre la maladie.
Qu’en penser par rapport à la réaction au vaccin ? D’autre
part, puisque les plaques séniles ne sont pas corrélées à
la progression de la maladie, pourquoi les combattre, alors
qu’il faudrait plutôt attaquer la dégénérescence neuro-
fibrillaire
?
Réponse
Il est difficile de répondre. Deux courants s’opposent :
tauistes et baptistes.
Le principal argument en faveur de la piste du peptide
amyloïde est que les trois mutations géniques qui
s’accompagnent d’une MA familiale, interviennent sur la
cascade amyloïde. Par l’immunothérapie, on choisit de lut-
ter contre les plaques amyloïdes. Se pose la question du
risque de désagréger des plaques qui sont peut-être un
mode de protection : c’est peut-être une façon de neutra-
liser des oligomères, potentiellement toxiques. Cela dit,
même si on avait un effet négatif du vaccin, ce n’est pas
pour autant que l’hypothèse de la cascade amyloïde serait
infondée.
On peut agir sur la cascade :
– soit en inhibant la formation de nouvelles plaques
(production de peptides A), par les inhibiteurs de sécré-
tases. Cette approche est la meilleure façon de tester
l’hypothèse de la cascade amyloïde car en agissant sur
les plaques, on n’est pas sûr d’avoir un effet positif ;
– soit en inhibant la dégénérescence neurofibrillaire.
1
/
3
100%