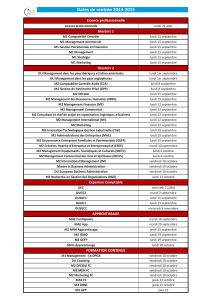
23.01.17 – 11h à 12h – Pharmacologie et principes d

SNP –Pharmacologie et principes d’utilisation des médicaments antiépileptiques (MAE)
1/10
23/01/2017
GILAND Valentine D1
CR : DESIRA Maxime
SNP
Pr Bartolomei
10 pages
Pharmacologie et principes d’utilisation des médicaments antiépileptiques (MAE)
Plan
A- Notions physiopathologiques
B- Modèles d’activités épileptiques
C- Médicaments anti-épileptiques (MAE)
D- Mode d’action des MAE
I- Blocage des canaux sodium voltage dépendants
II- Action sur la transmission GABA
III- Autres mécanismes
E- Propriétés pharmacologiques des MAE
A- Notions physiopathologiques
Maladies hétérogènes toutes caractérisées par des troubles des rythmes du cerveau, c’est à dire des
anomalies d’excitabilité du cortex cérébral qui peuvent être :
- généralisées : réseaux hyper excitables qui intéressent à la fois le cortex et le thalamus, on parle de
boucles thalamo-corticales hyper-excitables ;
- focales : d’origine néo-corticale, ce sont des zones hyper-excitables, avec des troubles du rythme qui
se propagent.
Les MAE sont des médicaments symptomatiques, ils ne traitent pas la cause de l’épilepsie. Les causes des
épilepsies sont très variables : génétiques (un seul gène ou plusieurs), acquises (traumatismes, hypoxie,
AVC, SEP), ou association des deux. La première prescription des MAE doit, en théorie, n'être réalisée que
par des neurologues, des spécialistes. En pratique, 95% des MAE sont prescrits par des généralistes.
Certains MAE sont également utilisés en psychiatrie.
B- Modèles d’activités épileptiques
Pour comprendre comment marche un médicament épileptique, on utilise des modèles. Le cerveau humain
étant difficile d'accès, on étudie l'épilepsie à travers des modèles animaux :
- In vivo :
Modèles aigus d'épilepsie : injection de drogues qui provoquent des crises (pénicilline, PTZ)
Modèles chroniques : animaux génétiquement épileptiques ou rendus épileptiques par des lésions
épileptogènes en injectant des agents excitotoxiques (acide kaïnique, pilocarpine)
- Ou in vitro: tranches d'hippocampes ou cortex de souris mis en culture, puis application des agents
épileptogènes afin de voir comment ces agents vont aboutir à la formation des crises.

SNP –Pharmacologie et principes d’utilisation des médicaments antiépileptiques (MAE)
2/10
- Modèles bio-informatique : on peut, à partir de mécanismes suspectés, créer des modèles de masse
neurale puis générer une activité épileptique "in silico".
Quand on étudie un tissu épileptique, le marqueur de l'hyperexcitabilité cellulaire est une dépolarisation
géante paroxystique ou PDS (Paroxysma Depolarisation Shift) : c’est une sorte de PPSE géant, ce sont
des activités sommées qui créent une pointe d’activité épileptique qu’on enregistre, notamment pour étudier
les mécanismes biologiques qui provoquent l’épilepsie.
Comment générer ces PDS qui témoignent de l'excitabilité du système ?
Par modulation des facteurs synaptiques (récepteurs) et des canaux ioniques :
augmentation de l'activation (dépolarisation) par augmentation de l’activité des :
- Canaux Na+ (augmente l'entrée d'ions Na+ dans la cellule)
- Canaux Ca++ (augmente l'entrée d'ions Ca++ dans la cellule)
- Récepteurs glutamate (NMDA/non NMDA) (augmente l'entrée d'ions Na+ dans la cellule)
Augmentation de la dépolarisation post-synaptique → PDS → hyperexcitabilité cellulaire →
activités électriques épileptiformes (correspondent à la pointe épileptique après sommation sur l'EEG).
diminution de l'inhibition par diminution de l’activité des :
- Canaux K+ (diminution de la sortie d'ions K+ dans la MEC)
- Récepteurs GABA (diminution entrée d'ions Cl- dans la cellule)
Augmentation de la dépolarisation post-synaptique → PDS → hyperexcitabilité cellulaire →
activités électriques épileptiformes.
Toutes les recherches ont donc pour but de savoir si ces facteurs sont modifiés et comment ils sont modifiés
dans le tissu épileptique. Quand on recherche le mode d’action des médicaments épileptiques, on va regarder
en priorité leur action sur ces différents systèmes.
On imagine bien que les MAE vont avoir un effet inverse sur ces mécanismes, ils vont :
- diminuer l’excitation.
- augmenter l’inhibition.
Exemples :
Dans les modèles in vitro, on regarde une tranche d’hippocampe au microscope, on enregistre les neurones,
et en intra-cellulaire, si on bloque le GABA avec la bicuculline (médiateur inhibiteur), on provoque des
PDS (activité épileptique).
Si on stimule les récepteurs au glutamate avec l’acide kaïnique (récepteurs non NMDA) on obtient
également une PDS entraînant une activité épileptique.
On peut également appliquer de la vératridine, qui permet une ouverture prolongée des canaux Na+, et
donc une hyperactivation des neurones.
On peut regarder sur un modèle chronique d’épilepsie chez l’animal, s'il y a des modifications de ce type.

SNP –Pharmacologie et principes d’utilisation des médicaments antiépileptiques (MAE)
3/10
Pour cela, on crée :
- Un phénomène initial : injection de neurotoxine, traumatisme crânien (animal endormi au
préalable) ; on provoque une lésion post-traumatique chez l'animal.
- Une période de latence : développement d’une épileptogénèse, il va se produire un certain temps
avant que le tissu ne se mette à produire des activités électriques anormales.
- Des études ont montré qu’au cours de cette épileptogénèse, les mécanismes d’hyper-excitabilité se
mettent en place : il y a des modifications plastiques de la synaptogénèse, des fibres bourgeonnent,
augmentation des récepteurs kaïnate, etc…
Chez l’homme, il est plus difficile d’étudier ces mécanismes, mais on peut, sur un tissu prélevé lors de
chirurgies d’épilepsies où on enlève la zone focale épileptogène, analyser l’expression des canaux,
récepteurs GABA (analyses histologiques, biologie moléculaire…).
Par exemple, dans une lésion qu’on appelle gangliogliome (épilepsie temporale) il y a une diminution de
l’expression des canaux potassium au niveau des neurones de cette lésion.
On a mis en évidence des dizaines gènes associés aux épilepsies, surtout dans certaines formes familiales
d’épilepsies. Ce sont en général des mutations qui touchent les canaux ioniques, comme par exemple la
mutation ponctuelle SCN1A, sur une sous-unité alpha du canal sodium de type 1 dans le cerveau, qui crée
le syndrome de Dravet (épileptologue marseillaise).
- Il peut y avoir un gain de fonction du canal, et donc une hyper-excitabilité.
- Il peut aussi se produire une baisse de fonction qui touche les inter-neurones GABA qui servent à
l’inhibition.
Quelles que soient les circonstances, on utilise des MAE, purement anti-crises : ils n’agissent pas sur la
cause de la maladie.
C- Médicaments antiépileptiques
Introduits/ développés à partir du XXème siècle : on utilisait les bromides à la fin du XIXème siècle
mais avec des effets secondaires ++ : diminution de l'activité sexuelle, mentale. (Flaubert était bourré
de bromides → gros, perte de cheveux, peu d’activité sexuelle).
Action « anticrise » mais pas d'impact étiologique, uniquement symptomatique, donnés de façon
non spécifique.
Autres propriétés annexes, ils sont donc beaucoup utilisés en psychiatrie:
Antimigraineux : topiramate, valproate.
Antidouleur : pregabalin, gabapentine.
Thymorégulateurs : régulent les troubles de l’humeur : CBZ, LTG.
Trouvés sur la base de « screening » (hasard) systématiques de composés chimiques en laboratoire.
Sans hypothèse de physiopathologie, on teste des composés chimiques pour voir si par hasard ils ont
une activité antiépileptique (on crée des électrochocs et on regarde l’influence des molécules sur le
seuil permettant de créer un électrochoc).
Ce sont des traitements chroniques, utilisés au long cours, en monothérapie ou polythérapies. Le
problème est l’association de plusieurs MAE dans les polythérapies, qui peut créer des interactions
(synergies, antagonismes…), on essaie donc de développer des médicaments avec moins
d’interactions (notamment pharmacocinétiques).

SNP –Pharmacologie et principes d’utilisation des médicaments antiépileptiques (MAE)
4/10
20-30% des épilepsies sont pharmaco-résistantes : les crises persistent malgré les MAE,
polythérapies, donc on utilise d’autres approches (stimulation cérébrale, stimulation du nerf vague,
chirurgie d’épilepsie).
Historique des MAE :
Aujourd'hui, une vingtaine de MAE sont sur le marché. À partir des années 1990, le développement des
MAE s’est accéléré.
MAE anciens (1ère génération) :
1912 : Phénobarbital (Gardénal, Aparoxal).
1938 : Phénytoïne (Di-hydan, Dilantin) PHT (dérivé récent Fosphénytoine, prodilantin) → état de
mal épileptique.
1952 : Primidone (Mysoline) PRM.
1960 : Ethosuximide (Zarontin) ETH : le seul médicament qui est spécifiquement actif sur les
absences.
1964 : Carbamazépine (Tégrétol) CBZ : traitement de référence des épilepsies partielles, focales.
1967 : Valproate de Na+ (Dépakine) : le plus efficace dans les épilepsies généralisées.
Ce sont encore des médicaments importants pour les épileptologues : la Carbamazépine est le traitement de
référence pour les épilepsies partielles, et la Dépakine (médicament essentiel sans équivalent aujourd’hui)
est le médicament de référence des épilepsies généralisées.
MAE 2ème génération à partir des années 90 :
1991 : Vigabatrin (Sabril) : assez efficace, mais après introduction sur le marché, on a remarqué des
atteintes visuelles et progressivement un rétrécissement du champ visuel, sa prescription a donc
quasiment était arrêtée.
1994 : Felbamate (Taloxa) : quasiment plus utilisé car il a donné des hépatites et des atrésies
médullaires.
1995 : Gabapentine (Neurontin) GBP : pas très efficace, surtout utilisé dans la douleur.
1996 : Lamotrigine (Lamictal) LTG : très utilisé, de référence, notamment pour les femmes
épileptiques car on peut l'utiliser pendant la grossesse.
1997 : Topiramate (Epitomax) TPM : très utilisé.
2000 : Oxcarbazépine (Trileptal) OXC : très utilisé.
2000 : Levetiracetam (Keppra) LVT : le plus utilisé dans l'épilepsie partielle de l'adulte.
Lesmédicaments qui suivent sont plutôt utilisés en association dans l'épilepsie quand elle devient
difficile à traiter par une seule molécule :
2002 : Zonisamide (Zonegran) ZNZ
2006 : Prégabalin (Lyrica) PGB
2008 : Lacosamide (Vimpat)
2009 : Rufinamide (Inovelon)
2012 : Retigabine (Trobalt) : pratiquement plus utilisé, Eslicarbazepine (Zébinix)
2014 : Pérampanel (Fycompa), dernier médicament en date.

SNP –Pharmacologie et principes d’utilisation des médicaments antiépileptiques (MAE)
5/10
Ils ont en général moins d’effets secondaires et moins d’interactions médicamenteuses, ils ont une
meilleure pharmacocinétique et sont mieux tolérés.
Autres médicaments :
- Benzodiazépines : toutes ont des propriétés anti-épileptiques, mais certaines sont sur le devant de la
scène :
Diazépam (Valium)
Clonazépam (Rivotril) CNZ
Clobazam (Urbanyl) CLB
Midazolam (Buccolam)
Action rapide, utilisés dans l'urgence en cas de suspicion d'état de mal épileptique qui met en jeu le
pronostic vital du patient (voies IV, IR, buccales).
D- Mode d’action
Ce sont des anti-excitants, ils s'opposent à l'hyperexcitabilité cellulaire en :
- Diminuant l'activation (dépolarisation) des neurones
- Augmentant l'inhibition des neurones
Un médicament épileptique peut avoir plusieurs modes d'action, ce n'est pas toujours un mode
d'action unique.
Sur la synapse d'un neurone, il y a potentiellement beaucoup de cibles intéressées par les médicaments
épileptiques :
- canaux ioniques (sodium, potassium)
- neurotransmetteurs (GABAergique ou glutamatergique)
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%