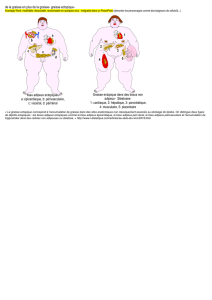
Multiplication et différenciation des cellules adipeuses - iPubli

SYNTHÈSE
Gérard Ailhaud
Professeur de biochimie.
Dàecteur de laboratoire au Cnrs
L

[6),
1
1



 6
6
 7
7
1
/
7
100%