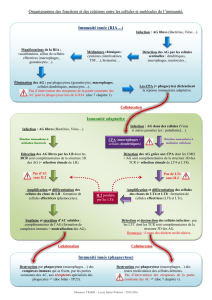
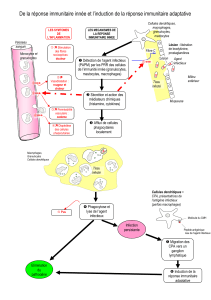
Les macrophages cérébraux - iPubli

SYNTHÈSE
%

1
X

1

782)

 6
6
 7
7
1
/
7
100%