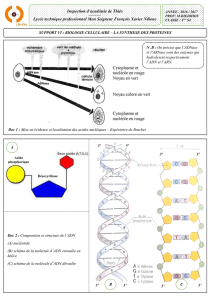
Spécificité de l`action des protéine kinases et - iPubli

SYNTHÈSE
1994; 10: 408- 16
Çuy Keryer
�ic Bly
Spécificité de l'action
des protéine kinases
et phosphatases dans
la cellule
L

AM
= =
= =
1

D

2).
0

1,
 6
6
 7
7
 8
8
 9
9
1
/
9
100%