Imagerie avant et après traitement

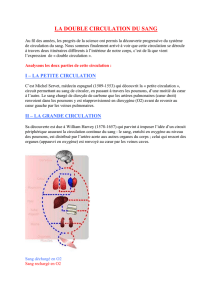
Imagerie avant et après traitement
endovasculaire de la fibrillation atriale
Mickaël OHANA, Mi-Young JEUNG, Soraya ELGHANNUDI,
Babé BAKOUBOULA, Catherine ROY
Poster Electronique – Travail Educatif
Nouvel Hôpital Civil – Hôpitaux Universitaires de Strasbourg - FRANCE

1. Traitement endovasculaire de la Fibrillation Atriale
1.1 Physiopathologie de la FA
1.2 Principes du traitement endovasculaire
1.3 Anatomie des veines pulmonaires
2. Planification de l'intervention
2.1 Intérêts et objectifs
2.2 Angioscanner des veines pulmonaires
2.3 AngioIRM des veines pulmonaires
2.4 Facteurs pronostiques
3. Suivi post-interventionnel
3.1 Complications précoces
3.2 Complications retardées
OBJECTIFS DU POSTER
Maitriser les protocoles d’acquisition TDM et IRM et les post-traitements utilisés en angiographie
veineuse pulmonaire.
Pouvoir fournir au cardiologue interventionnel les informations morphologiques et pronostiques
nécessaires à la planification de la procédure.
Assurer un suivi post-intervention adapté et savoir diagnostiquer les complications potentielles.
Abréviations : FA = Fibrillation Atriale, AG = Atrium Gauche, AD = Atrium Droit, VCI = Veine Cave Inférieure, VP = Veine Pulmonaire
Plan

Traitement endovasculaire
de la Fibrillation Atriale

Fibrillation Atriale
Le plus fréquent des troubles du rythme cardiaque (5% des +65ans – 10% des +80 ans)
Tachycardie supraventriculaire secondaire à une activité atriale anarchique
Cliniquement : palpitations, dyspnée, syncope ou révélation par des complications
(accident vasculaire cérébral, décompensation cardiaque)
Diagnostic positif à l’ECG : rythme irrégulier non sinusal avec disparition des ondes P,
remplacées par une oscillation irrégulière de la ligne de base (onde de FA)
Rythme sinusal régulier Rythme irrégulier sans onde P → FA
Camm AJ, Kirchhof P, Lip GYH & al. Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC).
European Heart Journal (2010). 31(19): p. 2369-2429.
4 types de FA selon la durée de l’épisode
Paroxystique : arythmie durant généralement moins de 48h, et toujours moins de 7j
Persistante : dure plus de 7j ou nécessite une cardioversion pour disparaitre
Persistante de longue durée : dure plus d’un an
Permanente : arythmie acceptée par le médecin sans cardioversion envisagée
Physiopathologie

Physiopathologie complexe
Nécessite un élément déclencheur et un substrat pour sa chronicisation
Apparition de foyers extrasystoliques à l’origine de la FA
Foyers prédominants autours des ostia des veines pulmonaires
Foyers pouvant aussi se voir autour de la VCS, du sinus coronaire, du toit de l’atrium gauche,…
Remodelage endomyocardique (altérations de la matrice extracellulaire et des myocytes)
aboutissant à une prolifération myofibroblastique avec fibrose et disparition du tissu atrial
Modifications de la conduction électrique secondaire à la fibrose et au remodelage,
avec présence de zones de conduction lente et de bloc de conduction
→ création de circuits de réentrées qui vont permettre la persistance de la FA
La destruction de ces anomalies anatomique permet d’éliminer l’arythmie
→ base des techniques ablatives curatives
Camm AJ, Kirchhof P, Lip GYH & al. Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC).
European Heart Journal (2010). 31(19): p. 2369-2429.
Physiopathologie
Indications des techniques ablatives dans la FA
FA paroxystique récidivante symptomatique avec traitement anti-arythmique inefficace (Ia)
ou en première intention (patient volontaire) (IIa)
FA persistante symptomatique après échec du traitement médical (IIa)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%