III) Réaction d`estérification

III) Réaction d’estérification
III.1. Résultat expérimental : voir TP10 C9
La quantité d’ester formé est déterminée par dosage acido-basique de l’acide restant à
l’instant t. Les quantités sont calculées dans les échantillons de 2mL soit dans Vtotal/12
état
Avancement
(mol)
CH3COOH + CH3CH2OH = CH3COOCH2CH3 + H2O
Initial
0
0
acide = 0,0167 mol
n
0
alcool = 0,0167 mol
n
0
0
Intermé-
diaire
x
0,0167 - x
0,0167 - x
x
x
final
xf = 0,0112
0,0167 - xf =
0,0055
0,0167 - xf =
0,0055
xf = 0,0112
xf = 0,0112
Final si
réaction
totale
xmax = 0,0167
0
0
0,0167
0,0167
III.2. Caractéristiques d’une estérification
Le tracé de la courbe ci-dessus montre que la réaction d’estérification présente un
équilibre à l’état final dans lequel il reste des réactifs.
D’autre part, cet état d’équilibre n’est pas obtenu rapidement.
La réaction d’estérification est une réaction lente et limitée.
Chap. C9 4/9
mélange initial :
3 2 5CH COOH C H OH
00
= = 0,2 mol
nn
t (min)
0
8
15
25
35
45
nester (t)
(mmol)
0
7,5
9,7
11,0
11,2
11,2

Pour mesurer l’efficacité d’une réaction, on introduit la notion de rendement :
Dans le cas d’un mélange équimolaire d’un acide carboxylique et d’un alcool primaire, le
rendement de la réaction d’estérification est r = 0,67 soit 67 %
Dans le cas d’un mélange équimolaire d’un acide carboxylique et d’un alcool secondaire, le
rendement de la réaction d’estérification est r = 0,60 soit 60 %
Dans le cas d’un mélange équimolaire d’un acide carboxylique et d’un alcool tertiaire, le
rendement de la réaction d’estérification est r < 0,1 soit r < 10 %
III.3. Calcul de Qr,i, K
Quotient de réaction Qr,i
0 =
[alcool]
×
[acide]
[eau]
×
[ester]
=
Qii
ii
ir,
car [ester]i = [eau]i = 0
Remarque : contrairement aux équilibres en solution aqueuse, l’eau doit impérativement
apparaître dans l’expression de la constante d’équilibre dans le cas de l’estérification :
c’est une espèce chimique qui ne se distingue pas des autres.
Constante d’équilibre K :
En considérant le volume constant V du mélange homogène de réaction :
[alcool]
[acide] [eau]
[ester]
=
Q=K éqéq
éqéq
éqr, ×
×
=
ff
ester eau ff
ester eau
ff ff
acide alcool acide alcool
nn
× n × n
VV
nn n × n
×
VV
A.N. : en reprenant les valeurs du tableau d’avancement, on trouve K = 4,7
Critère d’évolution spontanée de réaction
Qr,i K donc la réaction évolue spontanément dans le sens direct, c’est-à-dire dans le
sens de formation de l’ester.
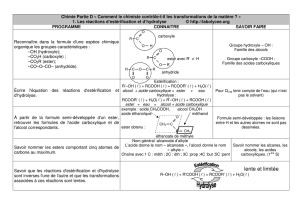
III.4. Comment rendre une réaction d’estérification plus rapide ? (TP11 C9)
en élevant la température
en utilisant un catalyseur, espèce chimique qui augmente la vitesse d’une réaction
chimique sans figurer dans l’équation de la réaction et sans modifier l’état d’équilibre
du système.
niacide = nialcool = 1 mol
Chap. C9 5/9
Le rendement r d’une réaction est égal au rapport
éq
max
n
rn
avec néq, quantité de matière obtenue du produit synthétisé
et nmax, quantité de matière attendue du même produit si la réaction est totale

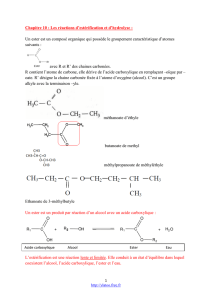
groupe caractéristique
=
+
III.5. Comment rendre la réaction d’estérification totale ou presque ?
III.5.a. En utilisant un des réactifs en excès
L’ajout d’un réactif (acide ou alcool) diminue le quotient de réaction : le système réagit
en consommant ces réactifs (sens d’évolution direct) afin d’atteindre l’équilibre défini
par K
mélange initial
(mol)
acide
5
2
1
1
1
alcool
1
1
1
2
5
xf en mol
0,95
0,86
0,67
0,86
0,95
Le taux d’avancement final augmente quand on utilise un des réactifs en excès
Calcul de xf pour n0acide = 2 mol et n0alcool = 1 mol :
K =
)
x
- 1 ( )
x
- 2 ( x
ff
2
f
×
= 4,7 donc xf²=4,7.( xf²- 3 xf + 2 ) soit 3,7. xf²- 14,1 xf + 9,4 =0
La résolution donne : xf = 2,95 mol > 1 mol (à rejeter) et xf = 0,86 mol
III.5.b. Par prélèvement d’un des produits de réaction
En prélevant un des produits de réaction au fur et à mesure qu’il se forme, on maintient
le quotient de réaction à une valeur faible (quasi nulle) : le système réagit en évoluant
dans le sens direct, c’est-à-dire vers la formation des produits. La réaction peut alors
avoir lieu jusqu’à épuisement des réactifs.
On peut prélever l’ester formé par distillation :
Cette méthode est applicable si et seulement si ébullition de l’ester est plus faible que
celles de l’acide, de l’eau et de l’alcool.
acide
alcool
ester
HCOOH
éb = 101 °C
CH3OH éb = 65 °C
HCOOCH3 éb = 31°C
CH3CH2OH éb = 78,5 °C
HCOOCH2CH3 éb = 54 °C
CH3COOH
éb = 118 °C
CH3OH éb = 65 °C
CH3COOCH3 éb = 57 °C
CH3CH2OH éb = 78,5 °C
CH3COOCH2CH3 éb = 77 °C
CH3CH(CH3)CH2CH2OH
alcool isoamylique éb = 128 °C
CH3COOCH2CH2CH(CH3)CH3
éthanoate d’isoamyle éb = 143 °C
on peut distiller les 4 premiers esters, mais pas le dernier
On peut prélever l’eau formée à l’aide d’un appareil appelé Dean-Stark
III.5.c. En utilisant un anhydride d’acide, plus réactif que l’acide
carboxylique. (TP12 C9)
Présentation :
Les anhydrides d’acide proviennent de l’élimination d’une molécule d’eau lors de la
réaction entre deux acides carboxyliques :
Chap. C9 6/9
1
/
3
100%