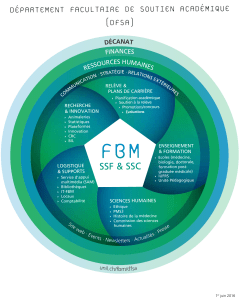
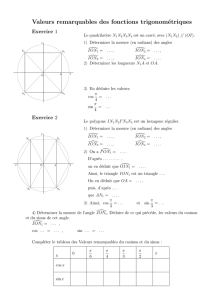
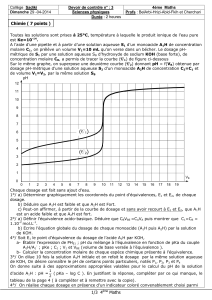
LM 9 Théorie de Brönsted notion d`équilibre

Thème 2 :


Le pH et sa mesure
I) Réaction chimique par échange de proton.


II. Solutions acido-basiques
1. Produit ionique de l’eau
Définition : On appelle produit ionique de l’eau la
grandeur :Ke=[H3O+]×[HO−]
Keest une grandeur sans unité alors que les
concentrations sont exprimées en mol.L−1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%