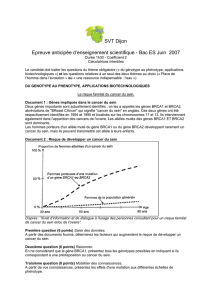
50 ans

Prédispositions génétiques aux
cancers
Dominique Stoppa-Lyonnet

T poumon, 70
T col utérus, 40 ?
T sein, 65
T foie, 80
T côlon, 65
T ORL, 70
65 ans T sein, 55
T sein, 75
? ? ?


Rétinoblastome : une tumeur rare de la rétine chez le
jeune enfant

Tumeur rare de l ’enfant : environ un enfant sur 15 à 20 000,
soit ~ 40 à 50 nouveaux cas /an
Dans 10% des cas, histoire familiale
•transmission dominante (un des deux parents atteint dans
l’enfance)
•le plus souvent atteinte bilatérale
•maladie précoce : dg avant 12 mois
Dans 90% des cas, pas d’histoire familiale
. 60% cas unilatéraux, 30% cas bilatéraux
Rétinoblastome : une tumeur rare de la rétine chez le
jeune enfant
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%