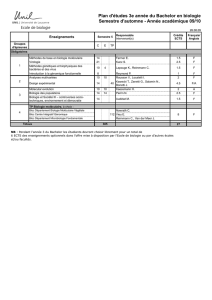
Spectroscopie de rotation moléculaire Modèle du rotateur rigide 1

UV-ANA1
Spectroscopie Atomique et
moléculaire
Isabelle Delaroche, D4
Spectroscopie de rotation moléculaire

Spectroscopie de rotation moléculaire
Introduction
Cas des molécules diatomiques en phase
gazeuse
E= Enélectronique + Evvibration + EJrotation
DEn>> DEv>> DEJ
Transition dans le domaine des micro-ondes

Spectroscopie de rotation moléculaire
I. Modèle du rotateur rigide
1. En mécanique classique
Le + simple
2
2
1
IEc
Où I=mr2
r
Objet ponctuel de masse m
Rotation uniforme (r,)

Spectroscopie de rotation moléculaire
I. Modèle du rotateur rigide
1. En mécanique classique
Cas d’une molécule diatomique en rotation
Deux masses ponctuelles m1et m2en rotation uniforme autour du centre de
gravité G

Spectroscopie de rotation moléculaire
I. Modèle du rotateur rigide
1. En mécanique classique
Cas d’une molécule diatomique en rotation
Introduction d’une particule réduite
21
21 mm mm
et r=r1+ r2
et r=r1+ r2
Où I=r2
2
2
1
IE
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%