zambon - E-compendium.be

Société pharmaceutique
(ZAMBON)
1. DÉNOMINATION DU MÉDICAMENT
Dolzam Retard 100 mg comprimés à libération prolongée.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient 100 mg de chlorhydrate de tramadol.
Excipient à effet notoire: chaque comprimé à libération prolongée contient 0,8 mg de lactose monohydraté (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimés à libération prolongée.
Comprimés blancs pelliculés marqués de ‘TBD 100’.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Traitement des douleurs modérées à sévères.
4.2 Posologie et mode d’administration
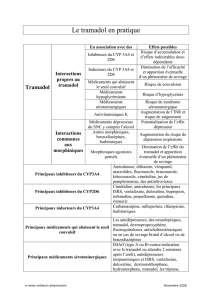
Les comprimés Dolzam Retard doivent être pris avec un intervalle de 12 heures et doivent être avalés entiers. Le patient ne peut pas
croquer le comprimé.
La posologie doit être adaptée à l’intensité de la douleur et à la sensibilité de chaque patient. La dose efficace la plus faible pour
obtenir l’analgésie sera généralement choisie. Le dosage correct pour chaque patient individuel est celui qui permet de gérer la douleur
pendant 12 heures sans effets secondaires ou avec des effets secondaires tolérables.
Les patients qui étaient traités avec des préparations de tramadol à libération immédiate doivent calculer la dose quotidienne totale; ils
doivent commencer par la dose de la gamme Dolzam Retard qui se rapproche le plus de la préparation précédente. Il est recommandé
aux patients de passer progressivement à des doses plus élevées afin de minimiser les effets secondaires temporaires. Etant donné que
des symptômes de sevrage et de manque ont été rapportés, la nécessité d’un traitement continu devrait être évaluée à intervalles
réguliers (voir rubrique 4.4). Sauf circonstances cliniques exceptionnelles, une dose quotidienne totale de 400 mg ne devrait pas être
dépassée.
Adultes et enfants de plus de 12 ans: La dose initiale est généralement d’un comprimé de 75 mg deux fois par jour. Si la douleur ne
s’estompe pas suffisamment, le dosage doit être augmenté jusqu’à ce que la douleur disparaisse.
Patients gériatriques: Il n’est pas nécessaire d’adapter la posologie chez les patients de maximum 75 ans dont il a été prouvé
cliniquement qu’ils ne souffrent pas d’insuffisance rénale ou hépatique. Chez les patients de plus de 75 ans, l’élimination du produit peut
être ralentie. C’est pourquoi l’intervalle posologique sera allongé si nécessaire, en fonction des besoins du patient.
Insuffisance rénale/dialyse et insuffisance hépatique: Chez les patients atteints d’insuffisance rénale et/ou hépatique, l’élimination du
tramadol est ralentie. Chez ces patients, un allongement des intervalles posologiques doit être soigneusement envisagé en fonction des
besoins du patient.
Le tramadol étant éliminé de façon très lente par hémodialyse ou hémofiltration, il n’est normalement pas nécessaire d’administrer du
tramadol après une dialyse dans le but de conserver l’effet analgésique.
Enfants de moins de 12 ans: L’usage de Dolzam Retard chez les enfants n’a pas été étudié. La sécurité et l’efficacité de Dolzam
Retard n’ont pas été établies chez les enfants et le produit n’est par conséquent pas conseillé pour les enfants.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1. Intoxication aiguë à l’alcool, aux
hypnotiques, aux analgésiques à action centrale, aux opioïdes ou aux médicaments psychotropes. Le tramadol ne peut pas être
administré aux patients qui reçoivent des inhibiteurs de la monoamine oxydase ou dans les deux semaines après l’interruption d’un tel
traitement.

Le tramadol ne peut pas être utilisé comme traitement de désintoxication aux substances narcotiques.
4.4 Mises en garde spéciales et précautions d’emploi
Mises en garde
A des doses thérapeutiques, des symptômes de sevrage ont été observés à une fréquence de 1 cas sur 8000. Des cas de dépendance
et d’abus ont été signalés moins fréquemment. En raison de ce potentiel, la nécessité clinique d’un traitement analgésique prolongé doit
être régulièrement remise en question.
Chez les patients ayant une tendance à faire un abus ou à présenter une dépendance aux médicaments, le traitement ne devrait être
seulement que d’une courte durée et se faire sous stricte surveillance médicale.
Le tramadol ne convient pas comme traitement de substitution chez les patients dépendants aux opioïdes. Bien qu’il s’agisse d’un
agoniste des opioïdes, le tramadol ne peut pas supprimer les symptômes de sevrage à la morphine.
Précautions
Des convulsions ont été rapportées à des doses thérapeutiques; ce risque peut être accru lorsque les doses dépassent les doses
journalières maximales habituelles. Les patients épileptiques ou susceptibles d’avoir des crises d’épilepsie ne peuvent être traités au
tramadol que pour des raisons impératives. Les risques de convulsions peuvent augmenter chez les patients qui prennent du tramadol
en même temps que des médicaments qui abaissent le seuil des attaques (voir rubrique 4.5).
Le tramadol doit être utilisé avec précaution chez les patients souffrant de lésions crâniennes, d’une augmentation de la pression
intracrânienne, de grave insuffisance rénale et hépatique et chez les patients sujets aux troubles convulsifs ou les patients en état de
choc.
Des précautions devraient être prises pour le traitement de patients souffrant d’une insuffisance respiratoire ou si des inhibiteurs du
SNC sont administrés en même temps vu que la possibilité d’une insuffisance respiratoire ne peut être totalement exclue dans ces
situations. A des doses thérapeutiques, une insuffisance respiratoire se rencontre rarement.
Ce médicament contient du lactose. Ce médicament ne doit pas être utilisé chez les patients présentant des maladies héréditaires rares
d’intolérance au galactose, de déficit en lactase de Lapp ou de malabsorption du glucose-galactose.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
L’administration simultanée de tramadol avec d’autres médicaments agissant sur le système nerveux central, y compris l’alcool, peut
potentialiser les effets inhibiteurs du système nerveux central.
Le tramadol peut induire des convulsions et augmenter le potentiel convulsivant des inhibiteurs sélectifs de la recapture de la sérotonine
(SSRI), des inhibiteurs de la recapture de la sérotonine-noradrénaline (SNRI), des antidépresseurs tricycliques, des antipsychotiques et
d’autres substances connues pour abaisser le seuil convulsif (telles que bupropion, mirtazapine, tétrahydrocannabinol).
L’utilisation thérapeutique concomitante de tramadol et de médicaments sérotoninergiques tels qu’inhibiteurs sélectifs de la recapture
de la sérotonine (SSRI), inhibiteurs de la recapture de la sérotonine-noradrénaline (SNRI), IMAO (voir rubrique 4.3), antidépresseurs
tricycliques et mirtazapine, peut causer une toxicité sérotoninergique. Un syndrome sérotoninergique est probable en présence d’un des
effets suivants:
• myoclonie
• clonus inductible ou oculaire avec agitation ou diaphorèse
• tremblements et hyperréflexie
• hypertonie et température corporelle > 38°C et clonus inductible ou oculaire.
L’arrêt des médicaments sérotoninergiques entraîne généralement une rapide amélioration. Le traitement dépend du type et de la
sévérité des symptômes.
Le traitement simultané avec la carbamazépine peut réduire l’effet analgésique à la suite d’une réduction des taux sériques de tramadol
et de son métabolite actif.
L’administration simultanée de cimétidine prolonge légèrement le temps de demi-vie du tramadol mais ce facteur n’est pas cliniquement
significatif.
Une administration simultanée de ritonavir peut augmenter la concentration sérique du tramadol et entraîner ainsi une toxicité du
tramadol.
Une toxicité de la digoxine a été rarement rapportée en cas d’administration simultanée de tramadol et de digoxine.
Autres dérivés de la morphine (y compris antitussifs, traitements de substitution), benzodiazépines, barbituriques: augmentent le risque
de dépression respiratoire, ce qui peut être fatal en cas de surdosage.

Agoniste partiel (agonistes/antagonistes par ex. buprénorphine, nalbuphine, pentazocine): l’effet analgésique du tramadol, qui est un
agoniste pur, peut être diminué et un syndrome de manque peut survenir.
On a rapporté des cas isolés d’interaction avec les anticoagulants coumariniques qui ont entraîné une augmentation du temps de
prothrombine exprimé en INR. Par conséquent, il faut être vigilant lorsque l’on débute un traitement au tramadol chez des patients qui
sont traités avec des anticoagulants.
L’effet analgésique du tramadol est en partie médié par l’inhibition du recaptage de la noradrénaline et la stimulation de la libération de
sérotonine (5-HT). Dans les études, l’application pré- ou postopératoire d’ondansétron, un agent antiémétique de la famille des
antagonistes des récepteurs 5-HT3, a augmenté les besoins en tramadol des patients souffrant de douleurs postopératoires.
4.6 Fertilité, grossesse et allaitement
Grossesse
Il y a peu de données disponibles relatives à l’usage du tramadol chez les femmes enceintes. Des études animales ont montré un effet
toxique sur la reproduction, mais aucun effet tératogène (voir rubrique 5.3). Le tramadol traverse la barrière placentaire et l’utilisation
chronique durant la grossesse peut provoquer des symptômes de manque chez le nouveau-né. C’est pourquoi le tramadol ne peut pas
être utilisé pendant la grossesse.
Le tramadol administré avant ou au cours de la naissance n’altère pas la contractilité utérine. Chez le nouveau-né, il peut provoquer des
changements de la vitesse respiratoire qui d’habitude ne sont pas significatifs cliniquement.
Allaitement
Durant l’allaitement, de très petites quantités de tramadol et de ses métabolites (environ 0,1% d’une dose intraveineuse) sont
retrouvées dans le lait maternel. C’est pourquoi, le tramadol ne peut pas être administré aux femmes qui allaitent.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Le tramadol peut provoquer de l’hébétude, une vision trouble et des vertiges, ce qui peut être renforcée par l’alcool ou d’autres
médicaments inhibiteurs du SNC. Si le patient en souffre, il/elle ne peut conduire des véhicules ou utiliser des machines.
4.8 Effets indésirables
Les effets indésirables sont classés selon les catégories de fréquences suivantes:
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100 à < 1/10)
Peu fréquent (≥ 1/1000 à < 1/100)
Rare (≥ 10000 à < 1/1000)
Très rare (< 1/10000)
Non connu (ne peut être évalué à partir des données disponibles)
Très
fréquent
Fréquent Peu
fréquent
Rare Très rare Non
connu
Affections
du système
immunitaire
Hyper-
sensibilité
Réaction
anaphylactique
Affections
métaboliques et
de
l’alimentation
Hypo-
glycémie
Affections
psychiatriques
Hallucinations
Cauchemars
Modifications
de l’humeur
Exaltation
Dysphorie
Diminution de
l’activité
Illusions
Agitation
Anxiété
Nervosité
Insomnie
Affections du
système
nerveux
Vertiges Céphalées Paresthésie
Augmentation
de l’activité
Trouble
Hyperkinésie
Tremblements

cognitif
Trouble
sensoriel
Trouble du
jugement
Convulsions
Affections
oculaires
Vision trouble
Affections
cardiaques
Palpitations
Tachycardie
Bradycardie
Affections
vasculaires
Hypotension
orthostatique
Collapsus
cardiovascu-
laire
Hypertension
Bouffées
vasomotrices
Affections
respiratoires,
thoraciques et
médiastinales
Dyspnée
Asthme
Dépression
respiratoire
Broncho-
spasmes
Respiration
sifflante
Affections
gastro-
intestinales
Nausées Vomisse-
ments
Sécheresse
buccale
Haut-le-
cœur
Constipation
Gêne
abdominale
Anorexie
Diarrhée
Trouble
digestif
Affections
hépatobiliaires
Augmentation
des valeurs
des enzymes
hépatiques
Affections de la
peau et du tissu
sous-cutané
Hyperhi-
drose
Prurit
Éruption
cutanée
Urticaire
Œdème
angioneuroti-
que
Affections du
rein et des
voies urinaires
Troubles de la
miction
Dysurie
Rétention
urinaire
Affections
musculo-
squelettiques et
systémiques
Faiblesse
musculaire
Troubles
généraux et
anomalies au
site
d’administration
Symptômes
de sevrage
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue
du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Agence fédérale des médicaments et des produits de santé
Division Vigilance
EUROSTATION II
Place Victor Horta, 40/40
B-1060 Bruxelles
Site internet: www.afmps.be
e-mail: adversedrugreactions@fagg-afmps.be
4.9 Surdosage

Les symptômes de surdosage sont du même type que ceux rencontrés avec les autres analgésiques opioïdes et sont entre autres:
myosis, vomissements, syncope cardio-vasculaire, sédation et coma, crises d’épilepsie et insuffisance respiratoire. Dans les cas
sévères, le surdosage au tramadol peut avoir une issue fatale.
Des mesures de soutien telles que le maintien de l’ouverture des voies respiratoires et le maintien de la fonction cardio-vasculaire
doivent être mises en place. La naloxone doit être utilisée pour inverser l’insuffisance respiratoire. Les convulsions peuvent être gérées
avec le diazépam.
Le tramadol est seulement très faiblement éliminé du sérum par hémodialyse ou hémofiltration. Par conséquent, l’hémodialyse ou
l’hémofiltration seules ne conviennent pas pour traiter une intoxication aiguë au tramadol.
Un lavage d’estomac est utile pour éliminer tout médicament non absorbé, surtout lorsqu’une formule à effet retard a été consommée.
5. PROPRIÉTÉS PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Classe Pharmacothérapeutique: analgésique à action centrale
Code ATC: N02A X02
Le tramadol est un agoniste pur non sélectif des récepteurs opioïdes μ, δ et κ avec une affinité plus élevée pour le récepteur μ. Les
autres mécanismes pouvant contribuer à son effet analgésique sont l’inhibition du recaptage neuronal de la noradrénaline et une
libération augmentée du 5-HT.
5.2 Propriétés pharmacocinétiques
Après l’administration orale d’une seule dose, le tramadol est presque absorbé complètement et la biodisponibilité absolue est
d’environ 70%. Le tramadol est métabolisé en O-desméthyltramadol qui s’est avéré présenter une activité analgésique chez les
rongeurs. La demi-vie d’élimination du tramadol est d’environ 6 heures, bien que cette période soit étendue à 12 heures environ après
l’absorption prolongée du comprimé Dolzam Retard.
Après l’administration d’un comprimé Dolzam Retard 75 mg à jeun, un pic moyen de concentration plasmatique (Cmax) de 80 ng.ml -
1 a été obtenu. Celui-ci a été associé à un tmax moyen de 5 heures (plage de 3 à 7 heures). En présence d’aliments, les propriétés de
disponibilité et de libération retardée des comprimés Dolzam Retard ont été maintenues sans aucun signe de «dose-dumping».
Une étude de proportionnalité d’une dose unique a confirmé une réponse pharmacocinétique linéaire (par rapport au tramadol et à l’O-
desméthyltramadol) après l’administration des comprimés de 75 mg, 100 mg, 150 mg et 200 mg. Une étude en steady state a confirmé
la bioéquivalence à dose adaptée des comprimés de 75 mg, 100 mg et 150 mg administrés deux fois par jour.
La pharmacocinétique du tramadol est non-linéaire. Les formules à libération plus rapide provoquent une accumulation de substance
médicamenteuse plus grande que celle prévue à partir des données de la simple dose, ceci est une conséquence d’un effet de premier
passage saturé.
La libération contrôlée du tramadol dans la gamme des comprimés Dolzam Retard minimise le phénomène de non-linéarité rencontré
avec les préparations à libération plus rapide.
Par conséquent, des études de simple dose et en steady state ont montré que, comparée aux préparations à libération immédiate, la
disponibilité moyenne du tramadol dans les comprimés de Dolzam Retard à 75 mg était environ de 82%. Sur cette base, il est
recommandé que le patient prenant du tramadol à effet immédiat passe au début à une dose quotidienne équivalente de comprimés
Dolzam Retard. Il peut être nécessaire de réajuster la dose par la suite. Les concentrations plasmatiques plus prévisibles peuvent
conduire à une titration de la dose plus facile à gérer.
5.3 Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée,
génotoxicité et cancérogénèse, n’ont pas révélé de risque particulier pour l’homme.
Des études avec des rats et des lapins n’ont pas révélé d’effets tératogènes. Toutefois, une embryotoxicité a été observée sous forme
d’une ossification retardée. La fertilité, la performance reproductrice et le développement de la progéniture n’ont pas été affectés.
6. DONNÉES PHARMACEUTIQUES
6.1 Liste des excipients
Noyau du comprimé
Huile végétale hydrogénée, talc, stéarate de magnésium.
Enrobage
Lactose monohydraté, hypromellose (E464), dioxyde de titane (E171), macrogol 4000.
 6
6
1
/
6
100%