Synthèse de la phénolphtaléine : Cours de chimie

Cours de chimie générale et organique - G. Dupuis - Lycée Faidherbe de LILLE
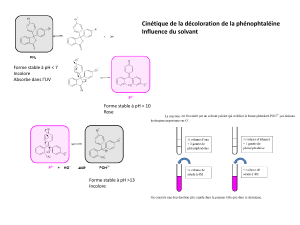
Synthèse de la phénolphtaléine
La réaction entre le phénol et l'anhydride phtalique en présence de ZnCl2 comme catalyseur
permet la synthèse d'un colorant utilisé comme indicateur acido-basique : la phénolphtaléine.
Pour pH < 7, la phénolphtaléine est un composé moléculaire noté PH qui, comme le phénol,
absorbe dans l'U.V et qui est incolore. Pour pH > 10, une fonction phénol est déprotonée.
L'intermédiaire initialement formé est instable et conduit à l'ion P- dans lequel l'atome de
carbone joignant les cycles est dans un environnement localement plan ce qui permet une
délocalisation des électrons π sur un système assez vaste pour que le maximum de la bande
d'absorption soit située dans le visible (λ m = 554 nm). La solution est fortement colorée en
rose.

Si le mélange est très basique, la solution se décolore lentement. OH- s'additionne sur l'atome
de carbone électrophile insaturé de la structure quinonique pour donner l'ion POH2- que sa
structure non conjuguée rend incolore.
La phénolphtaléine est un indicateur coloré très largement utilisé dans les dosages
acido-basiques. Sa zone de virage (de l'incolore au rose) étant comprise entre 8,2 et
10 on l'utilise lorsque le pH à l'équivalence est voisin de 9. A titre d'exemple, le
repérage de l'équivalence du dosage de l'acide éthanoïque pKa (AcOH/AcO-) = 4,7
de concentration 0,1 mol.L-1 par une solution de soude de concentration 0,1 mol.L-1
peut être détecté par le changement de couleur de cet indicateur.
SOURCE : Cours de chimie générale et organique - G. Dupuis - Lycée Faidherbe de LILLE
1
/
2
100%