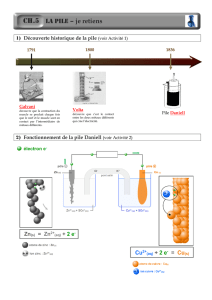
Les piles électrochimiques

Thème 1 : Confort dans l’habitat
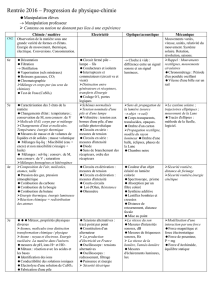
EX2bis L’alimentation électrique des appareils
Utiliser la classification des couples oxydant/réducteur
ci-contre pour répondre aux questions des exercices
Exercice 1
On plonge une barre d'un métal M dans une solution
contenant des ions d'un autre métal M'
Dans les expériences suivantes, indiquer s'il y a ou non
réaction (donc dépôt ) ; écrire l’équation de la réaction.
- une barre de zinc Zn dans une solution contenant des
ions Cu2+
- une barre de cuivre Cu dans une solution contenant des ions Zn2+
- une barre de fer Fe dans une solution contenant des ions Ag+
- une barre de zinc Zn dans une solution contenant des ions Fe2+
- une barre de fer Fe dans une solution contenant des ions Al3+
Exercice 2
1) Prévoir si les réactions suivantes sont possibles. Si c'est le cas, écrire l'équation bilan de
la réaction:
- réaction entre les ions aluminium Al3+ et l’argent Ag
- réaction entre les ions plomb Pb2+ et l’aluminium Al
- réaction entre le sions zinc Zn2+ et le plomb Pb
2) On plonge une bague en argent dans une solution de chlorure d'or contenant des ions
or Au3+. Que se passe-t-il ?
3) Écrire la réaction d'oxydo-réduction entre les couples Fe2+/Fe et Cu2+/ Cu
4) L’eau circulant dans une tuyauterie est acide. Une partie des raccords de tuyauterie est
en fer.
Une réaction chimique mettant en jeu les couples Fe2+/ Fe et H+/ H2 peut alors se produire.
Écrire cette réaction.

Exercice 3
On dispose de deux solutions ioniques, une
solution de sulfate de cuivre (Cu2+ ; SO42-)
et une solution de sulfate de zinc (Zn2+ ;
SO42-)
On place un clou en fer dans chacune des
deux solutions.
1)
1.1. Y a-t-il réaction entre la solution de
sulfate de cuivre et le clou en fer ? Justifier la réponse.
1.2. Y a-t-il réaction entre la solution de sulfate de zinc et le clou en fer ? Justifier la ré-
ponse.
2) Dans le cas où la réaction a eu lieu :
2.1. Écrire les deux demi-équations électroniques correspondantes.
2.2. Écrire l’équation bilan de la réaction d’oxydoréduction. Des deux réactifs, préciser
quel est l’oxydant et quel est le réducteur.
2.3. Qu’observe-t-on sur le clou ?
Exercice 4
Les deux métaux présents en majorité dans le bronze sont le cuivre Cu et l’étain Sn.
On verse de l’acide chlorhydrique (contenant des ions H+) dans un bécher contenant un
morceau de bronze.
1) Que se passe-t-il ?
2) Ecrire l’équation de la réaction chimique
Exercice 5
On veut réaliser une
pile constituée des
couples Fe2+/Fe et
Ag+/Ag.
- Indiquer, parmi les
schémas proposés ci-
dessous, celui qui est
correct.
- Indiquer pourquoi les
trois autres schémas
des piles sont incor-
rects.

Exercice 6
Pour les piles schématisées ci-dessous, indiquer :
- Les polarités de la pile
- le sens du courant électrique
- Le sens de déplacement des porteurs de charge
- Les réactions aux électrodes
Exercice 7
L’équation d’oxydoréduction modélisant le fonctionnement d’une pile plomb-argent est la
suivante
Pb + 2 Ag+ → Pb2+ + 2 Ag
- Proposer un schéma détaillant le montage à effectuer pour réaliser cette pile.
- Faire apparaitre le déplacement des porteurs de charge et indiquer les polarités de la pile.
- Indiquer les couples intervenant dans cette pile et les réactions aux électrodes
Exercice 8
On dispose de 2 électrodes, l’une en nickel et l’autre en zinc ; ainsi que deux solutions,
l’une contenant les ions Ni2+, et l’autre les ions Zn2+
On désire réaliser une pile nickel-zinc
- Faire le schéma de la pile
- Indiquer le sens de déplacement des porteurs de charge.
- Indiquer les réactions chimiques aux électrodes
- Au cours du fonctionnement de la pile, comment évoluent les aspects des électrodes ?
1
/
3
100%