Thesis - Archive ouverte UNIGE

Thesis
Reference
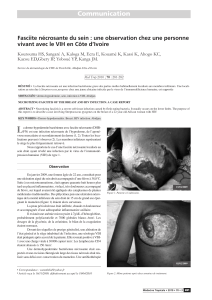
Prise en charge de la fascéite nécrosante de l'enfant avec épargne
cutanée
RUFENACHT, Magali
Abstract
La fascéite nécrosante est une infection mortelle et rapidement évolutive. Sa prise en charge
nécessite une antibiothérapie et de larges débridements. Nous avons analysé
rétrospectivement les cas traités en préservant la peau. Les données démographiques et
cliniques ont été extraites pour dix patients consécutifs. L’âge médian était 4.9 ans, la majorité
des lésions étaient dues à une varicelle et localisées au tronc. L’intervalle entre le début des
symptômes et la consultation était
RUFENACHT, Magali. Prise en charge de la fascéite nécrosante de l'enfant avec
épargne cutanée. Thèse de doctorat : Univ. Genève, 2016, no. Méd. 10833
URN : urn:nbn:ch:unige-912364
Available at:
http://archive-ouverte.unige.ch/unige:91236
Disclaimer: layout of this document may differ from the published version.
1 / 1

Section de Médecine Clinique
Département de l’Enfant et de l’Adolescent
Service de chirurgie pédiatrique
Thèse préparée sous la direction du PD Dr Giorgio LA SCALA et de la
Pre Barbara Wildhaber
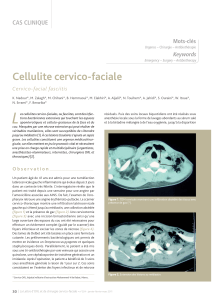
Prise en charge de la fascéite nécrosante de l’enfant
avec épargne cutanée
Thèse
présentée à la Faculté de Médecine
de l'Université de Genève
pour obtenir le grade de Docteur en médecine
par
Magali Sylvia Bernadette RÜFENACHT
de
Dotzigen (BE)
Thèse n° 10833
Genève
2016

Cette thèse a fait l’objet de la publication suivante:
Rüfenacht MS, Montaruli E, Chappuis E, Posfay-Barbe KM, La Scala GC.
Skin-sparing debridement for necrotizing fasciitis in children.
Plastic and Reconstructive Surgery 2016 September;138(3):489e-97e.
doi:10.1097/PRS.0000000000002478


3
Remerciements
Je tiens tout d’abord à remercier la Dre Eléonore Chappuis avec qui j’ai passé des week-ends
à extraire les données des dossiers des patients et qui a présenté à mes côté les premiers résultats
aux sociétés suisses de pédiatrie (SSP) et de chirurgie pédiatrique (SSCP). Je tiens également
à remercier le Dr Ernesto Montaruli qui nous a soutenues dans ces préparations et sans qui
l’article original n’aurait pu être réalisé.
Enfin, je remercie tout particulièrement le Dr Giorgio La Scala pour son soutien permanent
tout au long de ce projet, ses motivations, ainsi que son aide pour les statistiques et les astuces
informatiques.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
1
/
62
100%