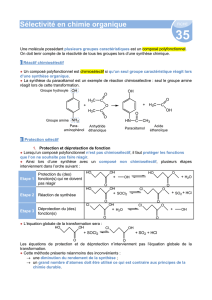
Obtention de molécules chirales

1
Synthèses d’acides α-aminés chiraux
Pr Pierre Strazewski, Laboratoire de Synthèse de Biomolécules, ICBMS, UCBL
1. Introduction: Structures, propriétés physico-chimiques, disponibilité
Rβ
H
3
N
COO
R'β
Rα
R'α
Rγ
H
3
N
R'γ
RβR'β
COO
Rα
R'α
H
3
NCOO
α
β
γ
δ
Rα
H
3
NCOO
R'α
Acides aminés protéinogéniques ayant des chaînes latérales neutres et hydrophobes:
pK1
pK2
pI
R = H ; R' = H : Gly (glycine) 2.359.785.97
R = H ; R' = CH3 : Ala (L-alanine) 2.35 9.87 6.02
R = H ; R' = isoProp : Val (L-valine) 2.29 9.72 5.97
R = H ; R' = isoBu : Leu (L-leucine) 2.33 9.74 5.98
R = H ; R' = (3S)-secBu : Ile (L-isoleucine) 2.32 9.76 6.02
R = H ; R' = CH2CH2SCH3 : Met (L-méthionine) 2.17 9.27 5.06
R = H ; R' = CH2Ph : Phe (L-phénylalanine) 2.58 9.24 5.48
R = H ; R' = CH2-3-indolyl : Trp (L-tryptophane) 2.43 9.44 5.88
: Pro (L-proline) 1.95 10.64 6.30
H
2
NCOO
2
Acides aminés protéinogéniques ayant des chaînes latérales non ioniques (en pH
neutre) mais hydrophiles: pK1
pK2 pK3 pI
R = H ; R' = CH2OH : Ser (L-sérine) 2.19 9.44 (>14) 5.68
R = H ; R' = (3R)-CH2(OH)CH3 : Thr (L-thréonine) 2.09 9.10 (>14) 5.60
R = H ; R' = CH2SH : Cys (L-cystéine) 2.58 9.24 10.34 5.48
R = H ; R' = CH2Ph-p-OH : Tyr (L-tyrosine) 2.20 9.11 10.07 5.67
R = H ; R' = CH2CONH2 : Asn (L-asparagine) 2.02 8.80 (>14) 5.41
R = H ; R' = CH2CH2CONH2 : Gln (L-glutamine) 2.17 9.13 (>14) 5.70
Acides aminés protéinogéniques ayant des chaînes latérales acides, donc anioni-
ques en pH neutre :pK1 pK2 pK3 pI
R = H ; R' = CH2COO– : Asp (L-aspartate) 1.99 3.90 10.00 2.98
R = H ; R' = CH2CH2COO– : Glu (L-glutamate) 2.13 4.32 9.95 3.22
acide L-aspartique
acide L-glutamique

3
Acides aminés protéinogéniques ayant des chaînes latérales basiques, donc (au moins
partiellement) cationiques en pH neutre :pK1 pK2 pK3 pI
R = H ; R' = CH2-4-ImidH+ : His (L-histidine) 1.87 6.05 9.15 7.95
R = H ; R' = CH2CH2CH2CH2NH3+ : Lys (L-lysine) 2.16 9.20 10.80 9.74
R = H ; R' = CH2CH2CH2NHC(NH2)NH2+ : Arg (L-arginine) 1.82 8.99 13.20 9.74
Dans l’eau tous les acides aminés, en tant qu’«acides aminés purs», se
présentent dans leur formes globalement neutres mais zwitterioniques.
Cette forme zwitterionique est la forme majoritaire dans l’eau ayant un pH qui
correspond au point isoélectrique pI de l’acide aminé. En pH plus acide la
forme globalement cationique est préférée (α-ammonium), en pH plus basique
la forme globalement anionique se présente (α-carboxylate).
La forme zwitterionique est la forme la moins soluble dans l’eau (à 25 °C : Tyr
40 mg/100 mL, les aa acides 0.5-0.9 g/100 mL, autres aa neutres 1-17 g/100 mL,
les aa basiques > 15 g/100 mL, Pro 162 g/100 mL).
Les crystaux des acides aminés purs sont particulièrement stables.
Les points de fusion sont entre 185 °C (Gln) et 342 °C (Tyr).
4
Tous les acides aminés protéinogéniques sont commerciaux, ils sont isolés des
hydrolysates de protéines (abats).
7-70 € / mol 70-140 € / mol 140-360 € / mol
Gly Lys, His, Phe, Met, Ile, Trp
Glu, Asp, Gln, Asn Tyr, Cys, Pro, Ser, Thr
Ala, Val, Leu, Arg
β-Ala D- et L-phénylglycine
α-MeAla
les
protéino-
géniques
les
synthé-
tiques
H3NCOO
par contre : 3,4-déhydro-L-proline
300 000 € / mol !!
H
2
NCOO

5
2. Synthèses racémiques:
Synthèse de Strecker non-spécifique (‘prébiotique’), amination directe,
amination indirecte, amination réductrice et amidocarbonylation
Synthèse de Stanley Miller 1952 :
hν acides carboxyliques +
CH4 + NH3 + H2O + H2α-hydroxyacides +
∆α-aminoacides +
(non stœchiométrique) réaction en phase
gazeuse, puis ‘goudron’
« atmosphère réductrice » extraction dans l’eau
plus tard :
CH4 + NH3 + H2O entre autres, les aminoacides:
CO + N2 + H2OGly + N-EtGly + N-PropGly + N-iPropGly +
CO + NH3 + H2 hν / ∆ Ala + N-MeAla + N-EtAla + β-Ala + N-Me-
CO + N2 + H2β-Ala + N-Et-β-Ala + Ser + Thr + AlloThr +
CO + NH3 + H2OVal + NorVal + Leu + Ile + AlloIle +
CH4 + N2 + H2O + traces NH3 Pro + α-AIB + γ-ANB
« atmosphères faiblement réductrices »
6
CO + CH4R-CHO
NH4+ CN–
R
NH2
C
N
R
NH2
C
NH2
O
R
OH
C
NH2
O
R
NH3
COO
R
OH
COOH
H2O
H2O
H2O
R
OH
C
N
H2O
Mécanisme : Formation de HCN, d’aldehydes (voir de cétones) par dismutation et
formation de liaisons C-C, suivi par la réaction de Strecker + hydrolyses partielles
=> α-aminonitriles => hydrolyse en α-hydroxynitriles + α-aminoamides +
α-hydroxyamides + α-hydroxyacides + α-aminoacides
2.1. Réaction de Strecker
NH4Cl + KCN

7
2.2. Halogénation, soit selon Hell-Vollhardt-Zelinsky, soit de
malonates, puis amination directe
COOH Prouge (ind.) + Br2COOH
Br
acide isobutyrique
NH
3
COO
NH
3
+
(D,L)-Val
EtOOC COOEt
malonate de diéthyle
1) NaH
2) Cl-CH2-Ph EtOOC COOEt
Ph 1) KOH
2) H3O+
3) Br2HOOC COOH
Ph
Br
∆
– CO2
Ph
COOH
Br
NH
3
Ph
COO
NH
3
+
(D,L)-Phe
8
2.4. Amination réductrice d’α-cétoesters
2.3. Amination indirecte de Gabriel
+NH
NH
O
O
H
2
N-NH
2
COOH
Br
COOH
N
OO
N
OO
KCOO
NH
3
COOEt
O
NH3+H2
Pd cat.
∆
COOEt
NH2
(D,L)-Ala-OEt
pyruvate d'éthyle
+

9
2.5. Amidocarbonylation de Beller
Angew. Chem. Int Ed. Engl. 2000, 39, 1010-27
RO
H
CH
3
O
H
2
N
+
CO (60 bar)
PdBr
2
/ 2 PPh
3
LiBr / H
2
SO
4
/ NMP
100 °C, 12 h
R
HN
COOH
CH
3
O
R = Alk, Ar, H
78-99 %
R
HN
OH
CH
3
O
R
HN
Br
CH
3
O
R
HN
Br
CH
3
O
R
HN
Pd
CH
3
O
PPh
3
Ph
3
PBr
Pd(II) CO
Pd
PPh
3
Ph
3
PBr
R
HN CH
3
O
O
– Pd(II) H
2
O
10
H
2
NCOOH
R
H
2
NCOOH
R
H
2
NCOOH
R
H
2
NCOOH
R
N
R
NH
R
N
R
O
R*
N
O
R*
R*
R*
R' H
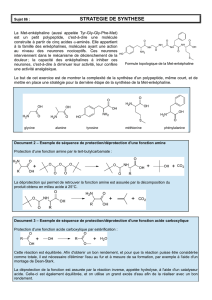
3. Synthèses asymétriques: Stratégies retro-synthétiques
L’induction asymétrique grâce au résidu R* permettra à une attaque diastéréo-
sélective ou diastéréo-faciale du réactif. R* sera donc soit un auxiliaire soit un
catalyseur chiral et préférablement énantiomériquement pur (M = métal).
Hydrogénation asymétrique
d’acides aminés α,β-insaturés,
voir d’α-iminoesters
Addition asymétrique sur
d’acides aminés α,β-insaturés
Strecker asymétrique avec
d’imines chirales
Carboxylation asymétrique de
carbanions d’amines chirales
N
R
O
R*
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%