Actualités thérapeutiques

Nouveautés thérapeutiques en neurologie et psychiatrie en 2006
Prof. JM. Maloteaux,
Service de Neurologie, Cliniques St Luc et Unité de Pharmacologie, UCL, Bruxelles
L’année 2006 fut elle caractérisée par de réelles nouveautés en matière de pharmacothérapie
neuropsychiatrique ? Indiscutablement oui si l’on considère les aspects fondamentaux, les
idées sous-jacentes aux développements et les mécanismes d’action de certains nouveaux
médicaments. Mais si l’on considère les apports cliniques réels, le bilan est beaucoup plus
modeste. C’est la conclusion que nous tirons régulièrement ces dernières années et cela doit
nous amener à reconnaître le dynamisme et les travaux de la recherche et développement des
industries pharmaceutiques mais aussi à tempérer les affirmations des départements de
marketing des mêmes entreprises.
Une originalité de certains nouveaux médicaments commercialisés ou enregistrés cette année
réside dans le mécanisme d’action. Des agonistes partiels, (aripiprazole, varenicline), des
antagonistes de récepteurs jusqu’ici peu ciblés tel le récepteur aux cannabinoïdes
(rimonabant), des voies d’administration originales ou encore des médicaments développés
pour le traitement de maladies rares : il y a de nombreux exemples du dynamisme des
chercheurs et cela mérite une admiration certaine. Le coût des nouveaux médicaments est de
plus en plus élevé pour un apport clinique parfois peu important par rapport aux produits plus
anciens et cela nous impose une réflexion de plus en plus critique en matière de rapport
coût/efficacité.
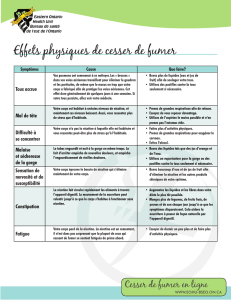
Tabagisme et dépendance
Les conséquences très graves du tabagisme justifient totalement une recherche de nouvelles
molécules qui aident à réduire voire supprimer la dépendance. La nicotine par voie
transcutanée et le bupropion (au mécanisme proche d’antidépresseurs) sont disponibles mais
agissent de façon peu sélective.
Récemment, les recherches fondamentales dans le domaine de la dépendance ont indiqué que
la plupart des dépendances impliquent les mécanismes de « récompense » qui sont localisés
dans les structures cérébrales profondes : l’aire tegmentale ventrale, le noyau accumbens et
les structures limbiques. Cette voie du tegmentum ventral au noyau accumbens utilise comme
neuro-médiateur essentiel la dopamine, qui est libérée sous l’effet de stimulations diverses :
opioides, alcool, cannabis, amphétamines, cocaine, nicotine, … Il existe donc sur les cellules
et prolongements de cette voie nerveuse profonde des récepteurs spécifiques (et souvent des
sous-types particuliers) pour ces différentes substances dont la nicotine. Cette voie est une
voie physiologique dont le rôle est de sélectionner de aliments « appétents », des substances
agréables à consommer, mais aussi des activités gratifiantes ou plaisantes (activités sociales,
ludiques, sportives, sexuelles…) mais c’est aussi une redoutable porte d’entrée pour des
substances et des toxiques qui via une stimulation excessive entraînent de la dépendance.
La nicotine est l’une des molécules de la fumée de tabac, elle stimule les récepteurs
nicotiniques cérébraux et exerce divers effets centraux et périphériques directs mais elle agit
aussi sur le noyau accumbens pour induire une libération de dopamine rapide et modulée.
Cette dernière est à l’origine de la « satisfaction » et de l’envie de poursuivre la prise; c’est la
base de la dépendance. Ce récepteur nicotinique cérébral du noyau accumbens est un sous-
type particulier parmi la vingtaine de récepteurs de la nicotine. Les récepteurs de la nicotine
sont des pentamères constitués de sous-unités différentes et la sous-unité alpha4beta2 est
spécifiquement impliquée dans la dépendance. Les modèles expérimentaux ont largement
démontré que l’absence de ce sous-type dans les modèles de rongeurs transgéniques se traduit
1

par une perte de dépendance et par une nette diminution de la libération de dopamine dans le
noyau accumbens en réponse à la stimulation nicotinique. Les chercheurs ont dès lors focalisé
leurs travaux sur des dérivés inhibiteurs, mais plus précisément agonistes partiels de ce sous-
type de récepteur nicotinique. Les résultats expérimentaux sont remarquables : la varenicline
(champix®) se lie avec une forte affinité mais n’active que modérément le récepteur, elle le
bloque aux doses plus élevées. Elle antagonise l’effet de la nicotine éventuellement prise
simultanément et réduit la consommation de tabac. Elle réduit les effets agréables et la
recherche de nicotine (dépendance). Les effets indésirables sont peu nombreux (digestifs et
neurologiques) et acceptables. Chez l’animal, il y a un effet inhibiteur net sur la voie
dopaminergique de la « récompense ». Sur papier, c’une molécule très intéressante et le
mécanisme d’action est très original. Les études cliniques sont positives mais moins
enthousiasmantes : une réduction du tabagisme (environ 15%) au terme d’un an, une
réduction de la consommation à plus long terme, peu d’effets indésirables graves, une
efficacité supérieure au placebo et au bupropion mais pas un effet spectaculaire. L’effet
s’atténue au fil des mois et il n’y a pas de réduction de la prise de poids qui accompagne
souvent l’arrêt du tabac.
Au vu de la gravité des effets du tabac, une efficacité modérée peut être considérée comme un
réel apport thérapeutique. Des études comparatives avec la nicotine transdermique manquent
mais l’efficacité est supérieure à celle du bupropion. Le médicament était déjà enregistré par
la FDA aux Etats-Unis, il est enregistré au niveau européen depuis décembre 2006
(Champix®), il est disponible sur prescription mais pas encore remboursé.
Excès pondéral, système cannabinoïde et rimonabant (acomplia®)
Les molécules disponibles pour la prise en charge de l’obésité sont peu nombreuses et le
problème clinique est énorme. Des risques graves ont entrainé le retrait de la fenfluramine et
de la dexfenfluramine et plus récemment l’interdiction des amphétamines. L’orlistat a des
effets indésirables assez importants et la sibutramine (dérivé de type antidépresseur)
également. L’orlistat a un mécanisme périphérique et inhibe la résorption de lipides au niveau
intestinal. Les autres médicaments exercent essentiellement leurs effets sur les amines
cérébrales (sérotonine, norepinephrine) et indirectement produisent une stimulation
dopaminergique du nucleus accumbens (cfr. varenicline). Le rimonabant est une entité
nouvelle, au mécanisme d’action très différent : c’est un antagoniste des récepteurs du
cannabis, de type CBR1 cérébraux. Le cannabis agit de façon spécifique dans le système
nerveux central sur des récepteurs très comparables à ceux de la morphine ou de la
dopamine ; un couplage à un système effecteur (protéine G) entraîne de multiples effets dont
la stimulation de la voie tegmentoventrale (dopaminergique) et du nucleus accumbens. Les
récepteurs cannabinoides sont présents dans diverses zones du système nerveux central et ils
influencent l’appétence : appétence ou plaisir de consommer des aliments, des boissons, des
substances telle le tabac et l’alcool … Le cannabis et les cannabinoïdes ont un effet stimulant
de l’appétit ; un inhibiteur des récepteurs CBR1 devrait au contraire réduire la recherche
d’aliments, de boissons ou de substances (tabac-nicotine) agréables… Les études pré-
cliniques vont dans le sens de cette théorie des récepteurs. Les essais cliniques indiquent des
résultats beaucoup plus modestes. Dans la dépendance tabagique, les essais cliniques sont non
concluants et l’EMEA (agence européenne des médicaments) a refusé l’indication au vu des
résultats présentés. Dans l’indication du traitement de l’obésité, l’enregistrement fut approuvé
mais les résultats sont modestes : une perte de 4 à 5 Kg est observée en un an de traitement
lorsque le rimonabant (20 mg/j.) est associé au régime par rapport au placebo. Peu d’effets
indésirables sont notés mais l’effet ne se maintient pas et à l’arrêt du traitement. Certaines
revues concluent à un effet modeste, inférieur à celui de l’orlistat et on ne peut certainement
2

pas parler d’une réussite clinique correspondant aux espoirs fondés sur un mécanisme
d’action nouveau.
Schizophrénie et antipsychotiques.
Ici aussi une molécule introduite il y a un peu plus d’un an est originale dans son mécanisme
d’action (aripiprazole, abilify®) mais d’un apport thérapeutique jusqu’à présent limité.
L’originalité de ce médicament antipsychotique est de ne pas bloquer complètement la
transmission dopaminergique au contraire des autres antipsychotiques. L’aripiprazole est un
agoniste partiel qui permet une activité dopaminergique basale mais inhibe une transmission
excessive. Cette propriété pharmacologique est remarquable et permet d’envisager moins
d’effets indésirables (liés au blocage dopaminergique soutenu), un effet éventuel dans les
situations de dépendance et toxicomanie, et un effet antipsychotique plus modulé…
Les études cliniques n’ont jusqu’à présent pas montré de supériorité de cet antipsychotique
dans le traitement des psychoses et certains risque ont été récemment soulevés (risque
suicidaire accru). Molécule originale au mécanisme d’action plus physiologique,
l’aripiprazole n’a pas encore fait la preuve d’une supériorité au niveau thérapeutique.
Nouveaux médicaments antiparkinsonniens.
L’azilect®, rasagiline, est un nouvel antagoniste de la monoamine oxidase (MAOB) qui se
révèle très proche de la selegiline. La MAOB est l’enzyme impliquée dans le catabolisme de
la dopamine et l’effet de la lévodopa est donc prolongé mais il n’y a pas de preuve de
neuroprotection.
Le stalevo® (association de levodopa-carbidopa-entacapone) est une association logique d’un
point de vue thérapeutique mais chère. Le duodopa® est une forme de levodopa
administrable par voie de jejunostomie sous forme de gel dans de rares cas où le patient ne
peut plus prendre un traitement par voie orale et où les fluctuations de l’effet thérapeutique
sont majeures. Extrêmement couteux et lourd à installer (intervention-jejunostomie-
conservation et utilisation des poches de traitement,), ce traitement ne concernera que de rares
cas de patients très invalidés au point de vue moteur avec une conservation des fonctions
intellectuelles.
La tolcapone (tasmar®) a été retirée il y a quelques années à la suite de complications
hépatiques graves. Le médicament qui est un inhibiteur de la COMT est aussi destiné à
réduire le métabolisme de la lévodopa. Le risque de toxicité persiste si des contrôles réguliers
ne sont pas effectués et ce médicament devrait rester d’utilissation très limitée.
Un agoniste dopaminergique (rotigotine, neupro®) administré par voie transdermique a été
enregistré en 2006, d’efficacité limitée et inférieure à celle d’agonistes utilisés par voie orale
(ropinirole), son intérêt restera limité.
Le dossier d’enregistrement de la rivastigine (exelon®) dans la maladie de Parkinson
associée à des troubles cognitifs (démence de type Alzheimer) avait été refusé par l’agence
européenne. A la suite de compléments d’information l’avis fut favorable mais les experts
indépendants furent peu enthousiastes. Le médicament est enregistré et devrait être remboursé
dans certaines conditions mais sont intérêt es contesté. Alors que la maladie de Parkinson était
traitée par des dérivés anticholinergiques il y a quelques années, et l’est encore parfois
actuellement, on propose ici un anticholinestérasique qui a évidemment des effets indésirables
sur le tremblement, les fonctions digestives et dont l’effet sur les fonctions cognitives est très
modeste.
Certains agonistes dopaminergiques sont très efficaces dans le traitement du syndrome des
jambes sans repos et une indication spécifique du pramipexole concerne cette indication.
3

Certains agonistes dopaminergiques dérivés de l’ergot de seigle (mais pas tous) présentent un
risque particulier de fibrose péritonéale, pleurale ou péricardique et en outre de fibrose des
valves cardiaques. De récents articles du New Engl. J. Med décrivent le mécanisme d’action
et les cellules impliquées : une activation sérotoninergique (5HT2B) de cellules des valves
cardiaques s’accompagne de stimulation de facteurs trophiques et de fibrose des valves dont
les conséquences peuvent être graves et parfois infra-cliniques. Ces médicaments doivent être
évités.
Autres
Quelques nouveaux médicaments dans le domaine du traitement des migraines (topiramate),
de l’épilepsie ou des troubles psychiatriques bipolaires (lamictal, lambipol®) seront discutés.
Les antidépresseurs du groupe des SSRIs sont toujours très utilisés, des recommendations
concernant les risques suicidaires et les risques en cas de grossesse ont été formulées par
l’EMEA. L’agomélatine, valdoxan® (impliquant le sytème mélatonergique et le système
sérotoninergique) devrait représenter un antidépresseur au mode d’action nouveau mais la
commercialisation est retardée. L’atomoxétine, strattera® est un nouveau médicament
indiqué dans le traitement des troubles de l’attention avec hyperactivité (ADHD) et un dérivé
du gamma hydroxybutyrate (oxybate, xyrem®) devrait être disponible pour le traitement de la
narcolepsie. Un dérivé (métabolite) de la risperidone à effet retard enrichira le volet des
neuroleptiques avec un mécanisme d’action conventionnel mais une pharmacocinétique
intéressante. Le sertindole (serdolect®) est un antipsychotique qui avait été retiré il y a deux
ans en raison de risques cardiaques par allongement de l’espace QT. Il a été réintroduit pour le
traitement en seconde ligne de la psychose mais il persiste un risque cardiaque potentiel qui
nécessite des précautions et il ne peut être envisagé qu’en cas d’échec d’autres traitements.
-----------------------------------------------
4
1
/
4
100%