Synthèse de l'Anhydride Diméthyltétrahydrophtalique - Diels-Alder

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 08 mars 2010
N°19 Diels-Alder
- 1 -
SYNTHÈSE DE L’ANHYDRIDE
DIMETHYL-4,5-CIS-TETRAHYDRO-
1,2,3,6-PHTALIQUE PAR ADDITION
DE DIELS-ALDER

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 08 mars 2010
N°19 Diels-Alder
- 2 -
1. Introduction
1.1 But du projet
Le but de cette expérience est de synthétiser de l’anhydride dimethyl-4,5-cis-tetrahydro-1,2,3,6-
phtalique par cycloaddition.
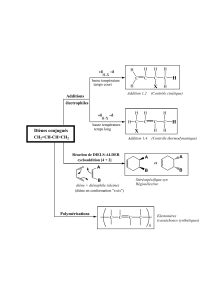
Les réactions de Diels-Alder sont des cycloadditions qui ont lieu entre un diène et un alcène :
diène alcène
1.2 Schéma de la réaction
La synthèse de l’anhydride dimethyl-4,5-cis-tetrahydro-1,2,3,6-phtalique est une cycloaddition du
diméthylbutadiène et de l’anhydride maléique. C’est un mécanisme qui se déroule en une seule étape :
2,3-dimethylbuta-1,3-diene
O
O
O
Anhydride Maléique
O
O
O
Anhydride diméthyltétrahydrophtalique
2. Déroulement de la synthèse
Tout d’abord, environs 10 mL de diméthylbutadiène sont distillés. 3 de ces 10 mL sont alors ajoutés à
2.51 g d’anhydride maléique dans un Erlenmeyer de 50 mL. On agite manuellement et après quelques
minutes la réaction à lieue et de la chaleur est dégagée. Il s’agit donc d’une réaction exothermique.
Le mélange est laissé de côté jusqu’à ce qu’il revienne à température ambiante et un précipité blanc
se forme.
Le précipité est lavé à l’eau froide par filtration sur büchner jusqu’à ce que l’eau du filtrat ne soit plus
acide et donc ne réagisse plus avec le papier au rouge de Congo. Les cristaux sont laissés sur büchner afin
de les sécher.
Pour purifier le produit une recristallisation est effectuée dans 50 mL d’éther à chaud. Lors de la
recristallisation les cristaux ne se sont pas extrêmement bien dissous dans l’éther. Malgré cela, une filtration à
chaud à été effectuée sur büchner, puis une cristallisation lente à permis d’obtenir les cristaux d’anhydride
dimethyl-4,5-cis-tetrahydro-1,2,3,6-phtalique.

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 08 mars 2010
N°19 Diels-Alder
- 3 -
3. Résultats et discussions
3.1 Rendement
Le rendement théorique pour cette synthèse est pratiquement quantitatif.
Dans cette réaction le réactif limitant est l’anhydride maleique car 0.0256 mol sont mises, contre
0.0265 mol de dimethylbutadiène.
Lors de cette expérience, 3.36 g de produit sont obtenus.
mol 0256.0
1.98
51.2 ====
anhydride
anhydride
produitanhydride MM
m
nn
et la masse de produit théorique à obtenir s’élève à :
g 61.42.1800256.0 =⋅=⋅=produitproduitthéorique MMnm
et le rendement obtenu est :
%9.72
61.4
36.3 ===
théorique
obtenu
m
m
η
3.2 Analyse spectre RMN
L’analyse du spectre RMN permet de déterminer la pureté du produit. On remarque qu’il n’est pas
tout à fait sec, il reste des traces dues au solvant. Mais la pureté est relativement bonne.
La molécule de l’anhydride dimethyl-4,5-cis-tetrahydro-1,2,3,6-phtalique est une molécule qui possède
un plan de symétrie.
Un premier singulet est présent à 1.72, il correspond aux 6H du methyl (Ha).
Deux doublets sont présents à 2.3 et 2.5, ils correspondent aux Hb et Hc. On aurait pu penser que
ces deux protons seraient équivalents, mais il n’en est apparemment rien. Ceci est certainement du à leur
stéréoisomérie, un étant vers le devant de la molécule et l’autre vers l’arrière, ils n’ont pas les mêmes
interactions avec leur protons voisin.
Le dernier pic présent correspond au dernier proton Hd, qui est le proton le plus déblindé étant donné
qu’il se trouve proche du cycle qui contient les oxygène.
De plus, nous pouvons confirmer que le produit de départ n’est plus présent, car les protons des
doubles liaisons se trouvent dans la région comprise entre environs 6.5-4.5 et dans notre spectre expérimental
aucun pic ne s’y trouve.
4. Conclusion
Cette synthèse à relativement bien fonctionné, étant donné le rendement obtenu qui est de 73 %. Et
d’après le spectre RMN, la pureté du produit est relativement bonne et le produit de départ n’est plus présent.

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 08 mars 2010
N°19 Diels-Alder
- 4 -
5. Questions
1. Ecrivez les structures des produits attendus dans les réactions suivantes :
Les réactions qui suivent sont toujours des réactions de cycloadditions, de Diels-Alder.
a) p-quinone + butadiène-1,3
O
O
p-quinone
buta-1,3-diene
O
O
4a,5,8,8a-tetrahydronaphthalene-1,4-dione
b) dihydro-1,2-styrène
108 HC!→!Δ
styrene
c) cyclopentadiène
1210 HC!→!Δ
3a,4,7,7a-tetrahydro-1H-4,7-methanoindene
cyclopenta-1,3-diene

TP de Chimie Organique
Fournier Coralie
Assistante : Francesca Giacomina 08 mars 2010
N°19 Diels-Alder
- 5 -
2. Quels sont les produits attendus dans les réactions rétro Diels-Alder :
Parfois les réactions de Diels-Alder peuvent être réversibles, elles sont alors appelée retro Diels-Alder,
ce’st les cas des réactions suivantes.
a)
CH2CH3
CH3
CH2CH3
CH3
(3S,6R)-3-ethyl-6-
methylcyclohex-1-ene
(2E,4E)-hepta-2,4-diene
alcène
b)
CH3
CH3
CH3
H3C
(4R,5R)-4,5-dimethylcyclohex-1-
ene
buta-1,3-diene (E)-but-2-ene
c)
O
O
O
O
alcène
2-oxabicyclo[2.2.2]oct-5-en-3-one 2H-pyran-2-one
 6
6
1
/
6
100%