Réponse immunitaire adaptative – partie 2

UE9 – Immunopathologie et Immunointervention
Lefebvre d’Hellencourt
Date : 15/04/2016 Plage horaire : 10h – 12h
Promo : P2 Enseignant : Dr Lefebvre d’Hellencourt
Ronéistes :
LEGRAND Jean Baptiste
SAINT-ALME Sébastien, le nommé « Coco Sec »
Réponse immunitaire adaptative – partie 2
I. Immunité par les lymphocytes T
1. Généralités
2. Activation des Lymphocytes T
A. Activation
B. Adhésion
C. Signal de co-stimulation
II. Les cellules présentatrice d’antigène
1. Les cellules dendritiques
2. Les macrophages
3. Les Lymphocytes B
4. Conclusion des CPA
III. Propriétés des lymphocytes T
1. L’interleukine 2
2. Les propriétés des lymphocytes T effecteurs
3. Activation des macrophages par les TH1
4. Activation des lymphocytes B par les TH2
A. Antigènes thymo-dépendants
B. Antigènes thymo-indépendants
C. Influence des cytokines
IV. Immunoglobulines et anticorps
1. Distributions et fonctions des immunoglobulines
2. Destruction des pathogènes : les anticorps
3. Déroulement de la réponse adaptative face à une infection
V. La réponse mémoire

I. Immunité par les lymphocytes T
1. Généralités
Les lymphocytes qui sont en circulation et qui n’ont pas rencontré d’antigènes sont considérés comme naïfs.
Et ceux qui rencontrent un antigène pourront être des effecteurs et agir sur des cellules cibles.
Les lymphocytes CD8 seront activés par des pathogènes viraux notamment.
La particularité de ces virus est de produire des protéines cytoplasmiques qui
vont être prises en charge par le CMH de classe 1 et donc présentées à la
surface des cellules. Ces peptides de surfaces provenant de ces pathogènes
vont être reconnus par des CD8 dont la fonction est de tuer ces cellules
infectées.
On aura aussi des lymphocytes T qui vont être activés par le CMH de classe
2. Ils sont dons activés par les pathogènes retrouvés dans les vésicules intra-
cytoplasmiques, par exemple provenant de la phagocytose des macrophages.
On va retrouver certaines bactéries qui sont présentes dans ces vésicules,
comme tuberculosis. Ces bactéries vont être dégradées en peptides qui vont
être présentés par le CMH de classe 2 à la surface du macrophage aux
cellules CD4, plus particulièrement les Th1 que l’on verra plus loin.
On aura également la reconnaissance par les immunoglobulines de surface
des Lymphocytes B, qui concerne les virus et les bactéries. Ces pathogènes
seront internalisés dans des vésicules. On va avoir les protéines qui vont être
dégradées et présentées par le CMH de classe 2 à la surface des lymphocytes
B. On aura, cette fois-ci, l’activation des Lymphocytes CD4, plus
particulièrement les Th2, qui vont permettre l’activation des LB et la
production d’anticorps.
2. Activation des Lymphocyte T
A. Activation
Comment va se faire la rencontre entre le LT et l’antigène ? Le LT naïf est dans la circulation, entre dans le
ganglion, il y aura alors contact entre LT et cellule présentatrice d’antigènes. Deux cas :
- soit le LT reconnaît l’antigène, s’active et devient effecteur
- soit il ne reconnaît pas, dans ce cas il retourne dans la circulation pour aller dans un autre ganglion.
L’activation des LT va se faire au niveau des organes lymphoïdes secondaires et non en périphérie au
niveau des sites d’infection. On aura donc besoin d’un transport de pathogènes ou de peptides correspondant
au pathogène, de la périphérie vers les organes lymphoïdes secondaires, où il y aura une interaction entre les
CPA et les Lymphocytes.
Selon la voie d’entrée des pathogènes, on aura des lieux d’interactions entre les pathogènes et les cellules
qui sont différents :
Les muqueuses sont associées aux MALT (plaques de Meyer, amygdales,…)
Le sang est associé à la rate, qui permettra de filtrer et de récupérer les antigènes des pathogènes.
(2015 et 2016 : Si on a une infection qui concerne le sang, ce sera surtout la rate qui servira d’organe
lymphoïde secondaire.)
Au niveau périphérique (muscle, sous-cutané…) ce sont les ganglions lymphatiques (on retrouvera
au niveau périphérique des cellules dendritiques qui seront capables de reconnaitre des pathogènes,
de les phagocyter (afin de capter des antigènes) et ensuite de migrer de la périphérie vers les
ganglions lymphatiques.)

Le transport par les cellules dendritiques est facilité par le fait qu’on a sur le site de l’infection : une
inflammation.
La réaction inflammatoire associée à la présence des pathogènes va avoir des conséquences sur la
présentation des antigènes :
- L’augmentation de la vascularisation va augmenter l’apport de CPA et va faciliter leur migration
vers les organes lymphoïdes.
- L’inflammation va également favoriser l’activation des cellules de l’immunité : lorsque les
cellules dendritiques immatures captent un antigène et qu’elles se trouvent dans un environnement
inflammatoire, elles vont plus facilement maturer. Les macrophages, quant à eux, seront plus actifs et
modifieront leurs molécules de surface.
Les lymphocytes T sont naïfs quand ils sortent du thymus. Les LT qui passent du thymus à la périphérie
après avoir subi la sélection positive/négative sont naïfs et vont entrer dans la circulation. Ils passeront de
la circulation vers les organes lymphoïdes secondaires où éventuellement ils vont rencontrer des CPA. Si
ces CPA possèdent des antigènes que le LT ne connait pas, à ce moment-là ces cellules ne vont pas
s’attacher plus longtemps et vont sortir du ganglion par la voie lymphatique. Par contre si ce lymphocyte T
qui rentre dans le ganglion lymphatique reconnait un antigène présenté par une CPA à ce moment-là le
contact qui a été initié par les molécules de liaison va se prolonger et on va avoir une activation du
lymphocyte T qui va commencer à proliférer.
B. Adhésion
Pour qu’il y ait possibilité de reconnaissance entre l’antigène et le TCR un
contact est important entre la CPA (Cellule Présentatrice d’Ag) et le LT
Il faut que le LT soit immobilisé pendant une certaine période avec la CPA.
Ce sont les molécules d’adhésion (intégrines…) qui font ce contact et qui le
maintiennent.
Ici on a plusieurs types de molécules d’adhésion, on retrouve des molécules
de la famille des CAM, des LFA-1 qui vont permettre ce contact entre la
CPA et le LT.
Ce contact entre les deux cellules va permettre d’avoir éventuellement une
interaction entre le CMH qui présente l’antigène et le récepteur.
C. Signal de co-stimulation (important)
L’activation des LT va nécessiter la reconnaissance du peptide présenté par le CMH
(1er signal) mais ce signal seul n’est pas suffisant. On aura aussi besoin d’un signal co-
stimulateur (2ème signal) qui va être donné par une Cellule Présentatrice d’Antigène
(CPA).
Cette co-stimulation passe par l’interaction des molécules B7.1 ou B7.2 situées à la
surface de la CPA (qui sont également appelées CD80 et CD86) et CD28 situé à la
surface du LT. Mais aussi par l’interaction du récepteur CD40 exprimé par la CPA et
le CD40L exprimé par le LT.

Une autre protéine va intervenir, CTLA-4 qui est un autre récepteur capable de lier B7 mais qui lui ne va
pas induire l’activation du Lymphocyte.
Le couple B7/CD28 est un activateur du Lymphocyte.
Alors que le couple B7/CTLA-4 est un inhibiteur du Lymphocyte.
Pour revenir à un niveau basal, suite à l’activation du Lymphocyte, on aura l’expression de CTLA-4 pour
diminuer cette activation.
Donc on aura le signal très important B7-CD28, également l’interaction CD40-CD40L et on aura par la suite
l’action de CTLA-4 pour contrôler cette activation.
Le signal de co-stimulation il est très important puisqu’on ne peut avoir une activation du lymphocyte T sans
ce signal. Et c’est de l’expression de B7 à la surface des CPA que va dépendre l’activation de ces cellules
par les antigènes.
Si vous avez une CPA qui n’est pas activée, elle n’exprimera pas B7 mais elle pourra quand même présenter
des antigènes. Ces antigènes pourront être reconnu par les LT mais comme il n’y aura pas le signal de co-
stimulation, le LT ne sera pas activé et entrera en Anergie. Il va être détruit par la suite.
Par contre lorsque la CPA est activé elle va présenter l’antigène et B7 et donc pourra activer des LT.
Donc selon l’environnement et l’activation des CPA on pourra avoir ou pas l’activation du LT.
Pour comprendre l’anergie : si on a des antigènes du soi qui sont porté par une CPA (à priori cette CPA ne
va pas être activée) elle n’exprime donc pas B7 et donc il n’y aura pas de co-stimulation. Ce qui permet
d’éviter qu’un LT qui reconnait les antigènes du soi d’être activé : il devient anergique. En général les LT
ou LB qui reconnaissent les cellules du soi sont des cellules qui n’ont pas passé la sélection négative.

Schéma récapitulatif
On voit juste l’activation du lymphocyte T via la CPA et grâce au signal de co-stimulation et au CMH.
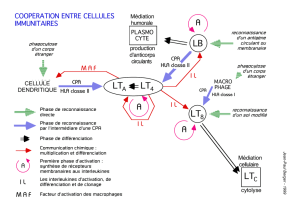
II. Les cellules présentatrices d'antigène
On a principalement 3 types de cellules qui sont présentatrices d'Ag: les cellules dendritiques, les
macrophages et les lymphocytes B.
1. Les cellules dendritiques
Les cellules dendritiques sont sous forme immature au niveau des tissus périphériques. Parmi ces cellules
immatures et inactivées ont va retrouver des cellules qui vont exprimer du CMH de classe I, du CMH de
classe II, des molécules d'adhésion type intégrines. Elles vont également exprimer DC-SIGN qui est un
marqueur particulier, spécifique aux cellules dendritiques. Et également dans la périphérie elles vont
exprimer à la surface une molécule qui est un récepteur appelé DEC 205 qui permet de capter les Ag.
→ En périphérie, cellule immature, qui capte l'Ag.
Lorsque cette cellule est activée et qu'elle devient mature, elle passe de la périphérie et migre dans les
organes lymphoïdes. Elle exprime toujours DC-SIGN, CMH de classe I et de classe II, et va exprimer en
plus B7.1, et B7.2 qui sont des signaux de co-stimulation qui permettent l'activation des lymphocytes T. Par
contre elle n'exprimera plus DEC 205.
→ On passe donc d'une cellule immature qui capte l'Ag à une cellule mature qui va présenter l'Ag et
exprimer les signaux de co-stimulation B7.1 et B7.2.
Il est important de bien faire les différences entre les cellules immatures qui captent les Ag et les cellules
matures au niveau des organes lymphoïdes qui présentent l'Ag et capable d'activer le lymphocyte T par les
signaux de co-stimulation.
Sur ce schéma on revoit en périphérie les cellules immatures présentent dans les tissus qui sont capables de
capter les Ag.
Alors qu'il y aura eu une blessure, une infection et
que les pathogènes vont rentrer, ils vont être capté
par les cellules dendritiques.
Sur la deuxième planche, il y’a activation des
cellules dendritiques par réaction inflammatoire
locale qui va permettre la migration et la
maturation de ces cellules de la périphérie par la
circulation lymphatique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%