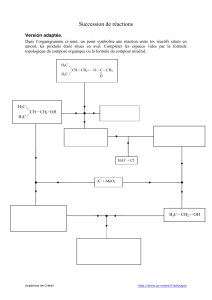
CH17 STRATEGIE DE SYNTHESE ORGANIQUE

Chap. 17 : Stratégie de synthèse
Questions :
a. Lors de l’extraction liquide-liquide, pourquoi
faut-il nécessairement que le solvant ajouté soit
non miscible au solvant d’origine ?
b. Lors d’une synthèse en milieu aqueux, on désire
isoler du benzaldéhyde. En utilisant les données
du tableau ci-contre, définir le solvant à utiliser
pour extraire ce benzaldéhyde.
c. Comment se nomme le procédé d’isolement de
la figure 4 ?
d. L’échantillon déposé est il pur ? Justifier.
e. Qu’observe-t-on sur l’image zoomée ?
f. Comment nomme-t-on la phase mobile ?
g. Comment expliquer qu’une espèce migre plus
vite que l’autre ?
Figure 1
:
Pictogrammes de sécurité
Figure 2
Ampoule
de coulée
Figure 3 : Evaporateur rotatif
miscibilité eau éther éthanol
benzaldéhyde faible forte forte
eau - nulle forte
Figure 4 : Méthode d’isolement
Figure 5 : Banc Köfler
Surface : de 50°C à 260°C
Prix : de 2000 à 3000 €

Chap. 17 : Stratégie de synthèse
Exemples :
Questions :
a. Donner les différents groupes caractéristiques présents dans la troisième molécule.
b. Nommer cette molécule
c. Donner la formule brute du para-aminophénol
Exemple : synthèse du paracétamol
L’anhydride acétique est chimiosélectif car il réagit préférentiellement avec une des deux fonctions présentes dans
le para-aminophénol.
Questions
a. Repérer les sites accepteurs d’électrons dans la molécule d’anhydride acétique. Justifier.
b. Au vu du produit obtenu, quelle est la fonction du para-aminophénol privilégiée par l’anhydride acétique ?
c. Quel est le nom de l’autre produit obtenu ?
d. Lorsqu’on fait réagir du permanganate de potassium sur du 3-hydroxybutanal on obtient la molécule
suivante :
Le permanganate de potassium est-il chimiosélectif ? Justifier.
Figure 5 : Réfractomètre portable (200 € env.)
Figure 6
Mesure avec un réfractomètre
CH
3
CH CH C
O
OH
NH
2
OH
OH
NH
2
CH
3
CH CH CH CH
2
CH
2
CH
3
OH
3-méthylhex-4-en-1-ol
para-aminophénol …………………………..
OHNH
2
C
H
3
O
O
CH
3
O
OHNH
CH
3
O
CH
3
OH
O
+ +
paracétamol
O
OOH

Chap. 17 : Stratégie de synthèse
Exemple : réaction de la soude avec l’aspirine
• A température ambiante seule la fonction ester (groupe
carboxyle) réagit.
• Lors d’un chauffage à reflux avec de la soude en excès
les 2 fonctions réagissent.
Exemple :
Lorsqu’on présente deux acides α-aminés, deux réactions
peuvent avoir lieu :
Pour en empêcher une au bénéfice de l’autre, on protège les fonctions que l’on souhaite préserver :
Ainsi, la seule réaction possible devient :
Pour finir cette synthèse, les deux
groupes protecteurs sont ensuite
clivés de leur position et on récupère
le produit final.
NH
O
OH
GP
1
NH
2
O
OGP
2
NH
O
GP
1
NH
O O
GP
2
+ +
H
2
O
Figure 6 :
Influence des
conditions
expérimentales
NH
2
O
OH NH
2
O
OH
Réaction 1
Réaction 2
NH
2
O
OH
NH
2
O
OH
NH
O
OH
GP
1
NH
2
O
OGP
2
Protection du groupement amine Protection du groupement carboxyle
NH
2
O
NH
O OH
Déprotection

Chap. 17 : Stratégie de synthèse
CORRECTION
Questions :
a. Lors de l’extraction liquide-liquide, pourquoi
faut-il nécessairement que le solvant ajouté soit
non miscible au solvant d’origine ? IL FAUT
DEUX PHASES NON MISCIBLES ? AINSI LE
COMPOSE A EXTRAIRE EST SEPARE DU
SOLVANT D’ORIGINE
b. Lors d’une synthèse en milieu aqueux, on désire
isoler du benzaldéhyde. En utilisant les données
du tableau ci-contre, définir le solvant à utiliser
pour extraire ce benzaldéhyde.ON VEUT
SEPARER LE BENZALDEHYDE DU MILIEU
AQUEUX, L’EAU ; ON UTILISE DONC
L’ETHER (MAIS PAS L’ETHANOL QUI EST
MISCIBLE à L’EAU)
c. Comment se nomme le procédé d’isolement de
la figure 4 ? CHROMATAGRAPHIE SUR
COLONNE
d. L’échantillon déposé est il pur ? Justifier. NON IL
CONTIENT DEUX ENTITES (ROUGE ET
VERTE)
e. Qu’observe-t-on sur l’image zoomée ? LA
DECOMPOSITION, LA SEPARATION DES
DEUX CONSTITUANTS
f. Comment nomme-t-on la phase mobile ?
L’ELUANT
g. Comment expliquer qu’une espèce migre plus
vite que l’autre ? L’ESPECE QUI MIGRE PLUS
RAPIDEMENT A MOINS D’AFFINITE AVEC LA
PHASE IMMOBILE : DES LIAISONS
S’ETABLISSENT ENTRE LA MOLECULE ET
LA PHASE IMMOBILE
Questions :
d. Donner les différents groupes caractéristiques présents dans la troisième molécule.amine (NH2) alcool
(OH) et acide carboxylique (COOH)
e. Nommer cette moléculeacide 3-amino-2-hydroxy-butanoique
f. Donner la formule brute du para-aminophénol C
6
H
7
ON
Exemple : synthèse du paracétamol
L’anhydride acétique est chimiosélectif car il réagit préférentiellement avec une des deux fonctions présentes dans
le para-aminophénol.
Questions
miscibilité eau éther éthanol
benzaldéhyde faible forte forte
eau - nulle forte
Figure 4 : Méthode d’isolement
OHNH
2
C
H
3
O
O
CH
3
O
OHNH
CH
3
O
CH
3
OH
O
+ +
paracétamol

Chap. 17 : Stratégie de synthèse
e. Repérer les sites accepteurs d’électrons dans la molécule d’anhydride acétique : les atomes de carbone
des doubles liaisons C=0. Justifier : les atomes d’oxygène fortement electronégatifs (présence de doublets
non-liants portant des charges partielles négatives attirent les electrons des liaisons covalentes, le
carbones se retrouve en defaut de charge partielle négative.
f. Au vu du produit obtenu, quelle est la fonction du para-aminophénol privilégiée par l’anhydride acétique ?
la fonction amine (NH2) est favorisée pour l’attaque de l’anhydride acétique
g. Quel est le nom de l’autre produit obtenu ? acide ethanoique
h. Lorsqu’on fait réagir du permanganate de potassium sur du 3-hydroxybutanal on obtient la molécule
suivante :
Le permanganate de potassium est-il chimiosélectif ?
Un réactif est chimiosélectif s’il ne réagit qu’avec un
groupe d’atomes caractéristique : ici nous avons une molécule qui est modifiée sur ses deux fonctions (hydroxy OH
est modifiée en cetone et aldéhyde modifiée en acide carboxylique) : le permanganate n’est donc pas chimioselectif
car il réagit sur deux groupe d’atomes différents.
O
OOH
1
/
5
100%