Document

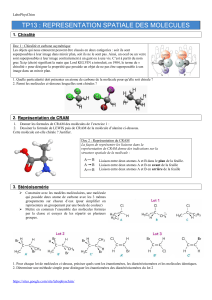
CHIMIE
ORGANIQUE
Night Tutorat
N°2-UE1

BASES POUR LA REPRÉSENTATION SPATIALE DE
MOLÉCULES
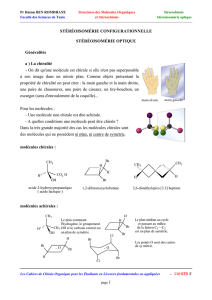
Représentation de
Cram (Appelée
aussi coin volant)
Projection de Newman, on se positionne dans l’axe de la liaison C-C
Représentation
de Fisher
(Série D-L
OH/NH2)

Isomérie : Même formule
brute
Plane
Spatiale: stéréoisomérie
(Même formule semi développée)
Isomérie de position
Isomérie de constitution
Groupements fonctionnels =/=
- Ramification =/=
- Position différente des groupements fonctionnels
Stéréoisomérie de conformation
Stéréoisomérie de configuration

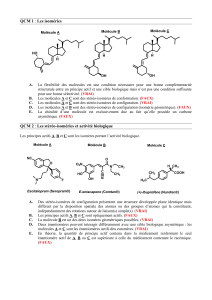
NOTION DE CHIRALITÉ
Pas de plan, ni de centre
de symétrie, non
superposable à son
image dans un miroir
Deux molécules chirales = Enantiomères
Ont des propriétés physico-chimiques identiques
mais peuvent avoir des propriétés biologiques
différentes
- Activité optique différente
- Lévogyre (< 0 dévie vers la gauche) -
- Dextrogyre ( > 0 dévie vers la droite) +
NE PAS CONFONDRE (+ - ), D et L , R et S

DETERMINER LA CONFIGURATION
ABSOLUE
Règles de CIP
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%