résumé des caractéristiques du produit

MAJ 090309 Validation Afssaps 1
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
Mis à jour : 09/03/2009
1. DENOMINATION DU MEDICAMENT
SEGLOR 5 mg, gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Mésilate de dihydroergotamine .................................................................................................. 5,00 mg
Quantité correspondant à:
- libération immédiate ................................................................................................................. 1,50 mg
- libération programmée .............................................................................................................. 3,50 mg
Pour une gélule.
Excipients: lactose, saccharose.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Gélule.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Traitement de fond de la migraine.
Proposé dans le traitement de l'hypotension orthostatique.
4.2. Posologie et mode d'administration
2 gélules par jour: une le matin et une le soir, à prendre au milieu des repas avec un verre d'eau.
4.3. Contre-indications
hypersensibilité connue aux dérivés de l'ergot de seigle,
en association avec les macrolides, sauf la spiramycine (voir rubrique 4.5),
en association avec les triptans (voir rubrique 4.5),
en association avec le l'amprénavir, l'atazanavir, le ritonavir, l'indinavir, le fosamprenavir, le nelfinavir
et le lopinavir (voir rubrique 4.5),
en association avec le voriconazole (voir rubrique 4.5),
en association avec la delavirdine, l'efavirenz (voir rubrique 4.5),
en association avec le stiripentol (voir rubrique 4.5),
en association avec la quinupristine et la dalfopristine (voir rubrique 4.5).

MAJ 090309 Validation Afssaps 2
en association avec le diltiazem, la phénylpropanolamine.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales
Ce médicament contient du lactose et du saccharose. Son utilisation est déconseillée chez les
patients présentant une intolérance au lactose et au saccharose.
Précautions d'emploi
La prise du médicament à jeun est déconseillée.
A utiliser avec précaution en cas d'insuffisance hépatique sévère et en cas d'insuffisance rénale
sévère non compensée par hémodialyse.
Une surveillance médicale est conseillée en cas d'antécédent pathologique artériel (notamment
maladie coronarienne et hypertension artérielle sévère).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations contre-indiquées
+ Macrolides (sauf spiramycine)
Par extrapolation à partir de l'érythromycine, de la josamycine et de la clarithromycine.
Ergotisme avec possibilité de nécrose des extrémités (inihibition de l'élimination hépatique des
alcaloïdes de l'ergot de seigle).
+ Ritonavir, indinavir, nelfinavir, amprénavir, atazanavir, fosamprenavir et lopinavir
Ergotisme avec possibilité de nécrose des extrémités (inhibition du métabolisme hépatique des
alcaloïdes de l'ergot de seigle).
+ Triptans (almotriptan, élétriptan, frovatriptan, naratriptan, rizatriptan, sumatriptan et
zolmitriptan)
Risque d'hypertension artérielle, de vasoconstriction artérielle coronaire. Respecter un délai de 24
heures entre l'arrêt du triptan et la prise de l'alcaloïde.
+ Delavirdine, éfavirenz
Ergotisme avec possibilité de nécrose des extrémités (inhibition du métabolisme hépatique des
alcaloïdes de l'ergot de seigle).
+ Voriconazole
Ergotisme avec possibilité de nécrose des extrémités (inhibition du métabolisme hépatique des
alcaloïdes de l'ergot de seigle).
+ Stiripentol
Ergotisme avec possibilité de nécrose des extrémités (inhibition de l'élimination hépatique des
alcaloïdes de l'ergot de seigle).
+ Quinupristine et dalfopristine (en association)
Ergotisme avec possibilité de nécrose des extrémités (inhibition du métabolisme hépatique des
alcaloïdes de l'ergot de seigle).
+ Diltiazem
Ergotisme avec possibilité de nécrose des extrémités (inhibition du métabolisme hépatique des
alcaloïdes de l'ergot de seigle).
+ Phénylpropanolamine
Risque de vasoconstriction et/ou de crises hypertensives.
+ Triclabendazole
Ergotisme avec possibilité de nécrose des extrémités (inhibition du métabolisme hépatique des
alcaloïdes de l'ergot de seigle).
Respecter un délai de 24 heures entre l'arrêt du triclabendazole et la prise du médicament dérivé de
l'ergot, et inversement.
Associations déconseillées
+ Bromocriptine, lisuride, cabergoline et pergolide

MAJ 090309 Validation Afssaps 3
Risque de vasoconstriction et/ou de poussées hypertensives.
+ Sympathomimétiques indirects (éphédrine, phényléphrine, pseudoéphédrine)
Risque de vasoconstriction et/ou de poussées hypertensives.
4.6. Grossesse et allaitement
Grossesse
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène. En l'absence d'effet
tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce
jour, les substances responsables de malformations dans l'espèce humaine se sont révélées
tératogènes chez l'animal au cours d'études bien conduites sur les deux espèces.
Il n'existe pas actuellement de données pertinentes pour évaluer un éventuel effet malformatif ou
fœtotoxique de la dihydroergotamine lorsqu'elle est administrée pendant la grossesse. Cependant, il
existe un risque théorique, à forte dose, d'action contracturante sur l'utérus.
En conséquence, par mesure de précaution, il est préférable de ne pas utiliser la dihydroergotamine
pendant la grossesse.
Allaitement
En l'absence de données sur le passage dans le lait maternel, le risque n'est pas connu: en
conséquence, l'allaitement est déconseillé pendant la prise de dihydroergotamine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Possibilité de nausées, surtout en cas de prise à jeun.
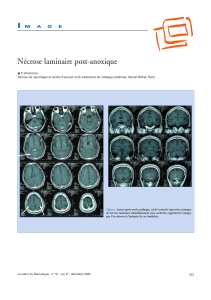
Manifestations de vasoconstriction périphérique: rares cas de paresthésies des doigts et des orteils,
d'ischémie périphérique et de cyanose périphérique.
Fibrose: exceptionnellement des cas isolés de fibrose (plèvre, espace rétropéritonéal) ont été
rapportés après plusieurs années de traitement.
4.9. Surdosage
Symptômes (ergotisme)
Douleurs abdominales, nausées, vomissements, céphalées, tachycardie ou bradycardie associées à
une hypotension, troubles respiratoires, vertiges, paresthésies au niveau des extrémités (dues à
l'ischémie).
Traitement
En cas d'intoxication aiguë, une évacuation digestive par lavage gastrique doit être envisagée en
milieu hospitalier. L'administration de charbon actif peut diminuer le passage digestif de la
dihydroergotamine.
En cas de confirmation d'ergotisme vasculaire, un traitement d'urgence doit être administré en milieu
hospitalier: il consiste généralement en une perfusion d'héparine associée à un vasodilatateur et
éventuellement aux corticoïdes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
ANTIMIGRAINEUX - ALCALOIDES DE L'ERGOT
Code ATC: N02CA01
In vitro, la DHE et la 8'-OH-DHE sont essentiellement caractérisées par:

MAJ 090309 Validation Afssaps 4
un effet agoniste sur les récepteurs 5HT1A présynaptiques dans le noyau du raphé dorsal et les
autres récepteurs neuronaux 5HT1A post synaptiques (hippocampe);
un effet antagoniste (hyperpolarisation) sur les récepteurs 5HT2A et 5HT2C;
une action agoniste sur les récepteurs vasculaires 5HT1B et une désensibilisation prolongée des
récepteurs 5HT2B;
une forte affinité pour les récepteurs 5HT1D et 5HT1F;
une puissante action antagoniste sur les récepteurs 5HT7;
une action agoniste partielle modeste sur les récepteurs adrénergiques α1 et α2 à l'origine d'un effet
vasotonique; action particulièrement marquée sur la circulation veineuse, en partie attribuée à la
synthèse d'une substance « prostaglandine-like ».
A doses élevées enfin, la dihydroergotamine se comporte comme un bloqueur des récepteurs alpha-
adrénergiques et sérotoninergiques.
5.2. Propriétés pharmacocinétiques
L'absorption du produit est rapide.
Le produit présente une forte affinité tissulaire.
L'élimination s'effectue essentiellement par voies biliaire et fécale.
5.3. Données de sécurité préclinique
Sans objet.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Saccharose, povidone K30, amidon de maïs, talc, lactose, copolymère d'acide méthacrylique et de
méthacrylate de méthyle (EUDRAGIT L 100), copolymère d'acrylates et de méthacrylates cationiques
(EUDRAGIT RL 100), diéthyle phtalate.
Composition de l'enveloppe de la gélule: gélatine, érythrosine, oxyde de fer jaune (E 172).
6.2. Incompatibilités
Sans objet.
6.3. Durée de conservation
2 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
30, 56 ou 60 gélules sous plaquettes thermoformées (PVC/Aluminium).

MAJ 090309 Validation Afssaps
5
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
UCB PHARMA S.A.
Défense-Ouest
420 rue d’Estienne d’orves
92700 COLOMBES
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
321 899-8: 30 gélules sous plaquettes thermoformées (PVC/Aluminium).
377 689-9: 56 gélules sous plaquettes thermoformées (PVC/Aluminium).
374 149-3: 60 gélules sous plaquettes thermoformées (PVC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
AMM 02/02/1978 / 30/11/2006 / 09/03/2009
10. DATE DE MISE A JOUR DU TEXTE
09/03/2009
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
CONDITIONS DE PRESCRIPTION ET DE
DELIVRANCE
Liste II.
1
/
5
100%