Autour du lait…

Christine RUELLEUX
Classe : 1ère STL Enseignement : Physique et chimie en laboratoire
THEMES du programme :
Analyse physico-chimiques
Chimie : enjeux sociétaux, économique et
environnementaux
Sous-thèmes :
Dosages par titrage
Synthèses et environnement
Autour du lait…
Extrait du BOEN
CONNAISSANCES CAPACITES
Titrage direct
Réaction support de titrage : acide-base (suivis pH-
métrique)
Chimie « verte »
Alternative à la pétrochimie : chimie des substances
naturelles
Analyse structurale. Spectroscopie IR.
Déterminer la concentration d’une solution
inconnue à partir des conditions expérimentales
d’un titrage.
Réaliser des titrages suivis par pH-métrie.
Citer quelques utilisations importantes des
agroressources en chimie organique
Utiliser des banques de données pour confirmer la
présence d’un groupe caractéristique (IR).
Compétences transversales et attitudes
- Rechercher, extraire, organiser des informations utiles
- Raisonner, argumenter
- Mettre en œuvre un dispositif expérimental
Type de ressource
- Activité expérimentale
- Banque de données
- Réinvestissement et/ou approfondissement
Résumé du contenu de la ressource
Mots clés de recherche : lait, polymère, développement durable, infra-rouge, dosage colorimétrique, dosage
pH-métrique.
Provenance : Christine RUELLEUX chri[email protected]

Christine RUELLEUX
AUTOUR DU LAIT…
On se propose de travailler autour d’une agroressource d’origine animale : le lait.
Pré-requis : équivalence d’un titrage, polymère/polymérisation (cours tronc commun), méthode
spectroscopique (Infra-Rouge).
Positionnement dans le programme : cette activité peut-être proposée en cours d’année en
réinvestissement de notions déjà abordées dans la spécialité Sciences Physiques et Chimiques et dans le
tronc commun physique-chimie.
Dosage d’un constituant du lait : l’acide lactique
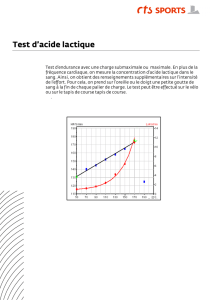
Objectif : Déterminer le degré d’acidité d’un lait.
Au cours du temps, sous l’action de bactéries, une partie du lactose du lait se transforme en acide
lactique de formule : CH3-CHOH-COOH. Lorsque l’acidité du lait augmente, la caséine (protéine)
coagule : on dit que le lait tourne. Moins le lait est frais, plus son acidité totale est grande : la mesure de
l’acidité d’un lait permet d’évaluer sa fraîcheur.
Un lait est caractérisé par son degré Dornic : 1 degré Dornic (1°D) correspond à 0,10 g d'acide
lactique par litre de lait. Un lait est considéré comme frais si son degré Dornic est inférieur ou égal à 18
°D.
Matériel :
- plusieurs laits : frais, ouvert depuis 4 jours, 7 jours, 10 jours…
- pH-mètre + solutions étalons
- solution d’hydroxyde de sodium de concentration 5.10-2 mol.L-1
- hydrogénophtalate de sodium solide pur
- phénolphtaléine
- erlenmeyers, béchers, pipette jaugée de 20,0 mL, poire d’aspiration, burette graduée
I) Etalonnage de la solution titrante
On dispose d’une solution d’hydroxyde de sodium (Na++HO-) de concentration environ égale à 5.10-2
mol.L-1. Pour connaître cette concentration avec précision, on l’étalonne à l’aide d’une solution
d’hydrogénophtalate de potassium pur à 99,8 %.
hydrogénophtalate de potassium
a) Ecrire l’équation du titrage
b) Calculer très précisément la concentration molaire CB de la solution de soude.

Christine RUELLEUX
II) Dosage pH-métrique
Proposer un protocole de titrage suivi par pH-métrie pour déterminer la concentration molaire en
acide lactique contenu dans un lait en utilisant le matériel et les produits mis à disposition.
Après validation par le professeur, réaliser plusieurs titrages du lait et exploiter les résultats.
III) Questions
1) Ecrire l’équation du titrage.
2) Déterminer la concentration molaire CA de l’acide lactique dans le lait.
3) Calculer la concentration massique tA du lait et en déduire le degré Dornic.
4) Conclure sur la fraîcheur du lait.
Données :
Hydrogénophtalate de potassium :
M = 204,18 g.mol-1
pKa (hydrogénophtalate de potassium/phtalate de potassium) = 5,5
Acide lactique :
M = 90,0 g.mol-1
pKa acide lactique/lactate = 3,9

Christine RUELLEUX
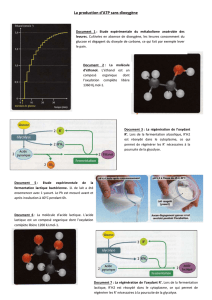
Synthèse d’un polymère biodégradable : le polylactate (PLA)
Objectif : Synthétiser un polymère biodégradable.
Le polylactate ou acide polylactique (PLA), est un polymère biodégradable fabriqué à partir de
ressources renouvelables. Il est issu de la polymérisation de l’acide lactique (acide 2-
hydroxypropanoïque).
Le lait contient un glucide, le lactose qui peut se transformer, par fermentation (réaction d’oxydation), en
acide lactique de formule semi-développée :
Les molécules d’acide lactique sont capables, dans certaines conditions, de réagir entre elles pour former
un polymère, nommé polylactate ou acide polylactique (PLA), dont la structure est :
Pour réaliser cette synthèse, il est nécessaire de travailler à température élevée et de déclencher la
polymérisation : on utilise un catalyseur, l’acide sulfurique concentré.
Matériel :
- acide lactique
- acide sulfurique concentré
- bécher en plastique de 250 mL (pour éviter que le polymère ne colle aux parois)
- bécher en verre de 50 mL
- éprouvette graduée de 10 mL
- plaque chauffante + thermomètre
- papier pH
- une baguette en verre
I) Expérience
1) Synthèse du polylactate
Introduire environ 10 mL d’acide lactique pur dans un bécher en plastique. Ajouter quelques gouttes
d’acide sulfurique, utiliser gants et lunettes de protection. Chauffer en portant progressivement la
température à 110°C. Agiter régulièrement pendant 30 min. Laisser refroidir. Le mélange se solidifie et
reste transparent : on a synthétisé le polymère.

Christine RUELLEUX
2) Biodégradabilité
Proposer un protocole pour montrer le caractère biodégradable du polymère synthétisé et le mettre en
œuvre.
II) Questions
1) Quelles sont les deux fonctions présentes dans la molécule d’acide lactique ?
2) Quel est le nom de la réaction entre ces deux groupes fonctionnels ?
3) Ecrire l’équation de la réaction entre deux molécules d’acide lactique, puis celle entre n
molécules d’acide lactique. Faire apparaître le motif du polymère.
4) Est-ce une réaction de polyaddition ou de polycondensation ?
5) Quel groupe fonctionnel obtient-on dans le polylactate ?
Travail personnel de recherche :
6) L’acide lactique utilisé en industrie n’est pas issu du lait. Proposer une explication.
7) D’où est issu l’acide lactique utilisé dans l’industrie ?
8) Le polylactate est utilisé notamment pour la fabrication de sachets plastiques biodégradables.
Rechercher d’autres applications de ce polymère.
9) Quels sont les avantages d’un polymère tel que le PLA en terme de développement durable ?
10) Quelles peuvent être les limites au développement de tels matériaux ?
III) Analyse du spectre Infra-Rouge de l’acide lactique
La spectroscopie Infra-Rouge (IR) est une méthode d’analyse qui permet de déterminer les groupes
chimiques présents dans une molécule. L’échantillon est traversé par un balayage de rayonnement Infra-
Rouge dont l’énergie peut être absorbée par la molécule. Certains rayonnements sont absorbés pendant
que d’autres sont transmis.
Un spectre IR indique la transmittance T (inverse de l’absorbance) exprimée en pourcentage, en fonction
du nombre d’onde σ (inverse de la longueur d’onde) exprimée en cm-1. Une transmittance de 100 %
signifie qu’il n’y a pas d’absorption ; de ce fait les bandes d’absorption d’un spectre IR pointent vers le
bas.
Exemple de spectre IR
Spectre extrait de http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/cre_index.cgi?lang=eng
 6
6
 7
7
 8
8
1
/
8
100%