lendormin (boehringer ingelheim) - E

LENDORMIN®
(BOEHRINGER INGELHEIM)
1. DÉNOMINATION DU MÉDICAMENT
Lendormin® 0,250 mg comprimés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un comprimé contient 0,250 mg de brotizolam.
Pour les excipients, cf : "Liste des excipients".
3. FORME PHARMACEUTIQUE
Comprimés.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Insomnie sévère, invalidante ou conduisant à une détresse psychologique.
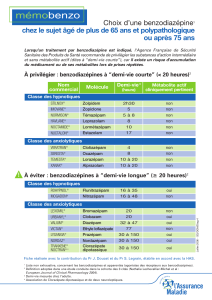
4.2 Posologie et mode d’administration
Sauf prescription contraire du médecin, la posologie recommandée est:
- adultes: 0,250 mg
- patients âgés: 0,125 mg à 0,250 mg.
Le LENDORMIN se prend juste avant le coucher, soit avec une gorgée de liquide, soit en laissant le comprimé se dissoudre sous la
langue.
On prendra le LENDORMIN l'estomac vide. Avant la prise de LENDORMIN, le patient s'assurera qu'il aura la possibilité de dormir
6 à 7 heures.
On commencera le traitement avec la plus petite dose recommandée. On n'excèdera pas la dose maximale de 0,250 mg vu le risque
accru d'effets indésirables inacceptables sur le système nerveux central. La dose sera réduite chez l'insuffisant hépatique à 0,125 mg.
Chez l'insuffisant rénal, les données disponibles ne demandent pas d'adaptation de la dose.
Le traitement sera aussi court que possible. La durée de traitement varie de quelques jours à deux semaines. La diminution progressive
de la posologie sera adaptée à chaque individu.
Dans certains cas, la prolongation du traitement au-delà de 2 semaines peut s'avérer nécessaire ; cette prolongation ne se fera pas sans
une réévaluation médicale du patient.
4.3 Contre-indications
Hypersensibilité à la substance active, le brotizolam, à l’un des excipients ou aux benzodiazépines. Myasthénie grave. Insuffisance
respiratoire sévère. Insuffisance hépatique sévère. Syndrome d'apnée du sommeil. Le LENDORMIN n'est pas destiné aux enfants.
4.4 Mises en garde spéciales et précautions particulières d’emploi
Dans de nombreux cas, l'administration de benzodiazépines répond à un besoin occasionnel ou passager et sera donc de courte durée.
Dans certains cas, l'état de santé du malade peut exiger une administration de plus longue durée. L'usage prolongé de benzodiazépines
implique dans chaque cas une réévaluation périodique de son utilité car il peut conduire à une dépendance psychique.
Une certaine perte d'efficacité des effets hypnotiques peut apparaître suite à l'usage répété pendant quelques semaines. Une
dépendance physique et psychique peut se développer.
Le risque de dépendance augmente avec la dose et la durée du traitement; ce risque est accru chez les patients enclins à la
consommation abusive d'alcool ou de médicaments. Si la dépendance physique s'est installée, l'arrêt brusque du traitement
s'accompagnera de symptômes de retrait. Ces derniers varient en sévérité, allant de troubles légers (comme des céphalées ou des
douleurs musculaires) jusqu'à des symptômes psychiatriques sévères (comme anxiété, tension nerveuse, confusion, irritabilité). Dans les
cas graves, on peut constater: déréalisation, dépersonnalisation, hyperacousie, extrémités engourdies et picotements, hypersensibilité à
la lumière, au bruit ou au contact physique, hallucinations ou crises épileptiques.
Un des premiers symptômes de développement d'une dépendance est l'apparition d'un phénomène de rebond, à savoir que les
symptômes (insomnie et anxiété) qui ont amené au traitement par une benzodiazépine réapparaissent de manière exacerbée à l'arrêt du
traitement. Ces symptômes peuvent s'accompagner d'autres réactions, comme des modifications de l'humeur, de l'anxiété, des troubles
du sommeil et de la nervosité.
Du fait que le risque d'apparition de phénomènes de rebond est plus élevé après une interruption brusque du traitement, on
recommande que la posologie soit diminuée progressivement.
Il est important que le patient soit conscient de l'éventualité des phénomènes de rebond, ce qui réduira son anxiété au sujet de ces

symptômes au cas où ils se produiraient à l'arrêt du traitement.
Il est nécessaire d'informer le patient lorsque le traitement commence, qu'il sera de durée limitée et de lui expliquer la manière dont la
posologie sera progressivement réduite.
Chez les patients âgés et chez les insuffisants hépatiques, une réduction de la posologie devrait être envisagée. Il en va de même chez
les insuffisants chroniques respiratoires avec hypercapnie, du fait du risque de dépression respiratoire nocturne.
Le brotizolam seul n'est pas recommandé pour le traitement des affections psychotiques.
On ne l'utilisera pas seul pour traiter la dépression ou l'anxiété accompagnant la dépression, du fait que, chez ces patients, un
comportement suicidaire peut s'en trouver précipité.
On n'utilisera pas le brotizolam chez des patients enclins à la consommation abusive d'alcool ou de médicaments.
Les benzodiazépines peuvent induire une amnésie antérograde. Ce phénomène apparaît généralement quelques heures après
l’administration. Afin de réduire ce risque, les patients doivent s’assurer qu’ils auront la possibilité d’avoir un sommeil ininterrompu
pendant 7 à 8 heures (cfr. «Effets Indésirables»).
4.5 Interactions avec d’autres médicaments et autres formes d’interaction
Lorsque le brotizolam est administré avec d'autres dépresseurs du SNC, il peut se produire une potentialisation des effets nerveux
centraux. Il y a lieu d'envisager de telles interactions potentielles avec des antipsychotiques (neuroleptiques), hypnotiques, anxiolytiques,
sédatifs, antidépresseurs, analgésiques narcotiques, anti-épileptiques, anesthésiques et antihistaminiques sédatifs.
L'euphorie, pouvant être provoquée par l'administration concomitante du LENDORMIN avec des analgésiques narcotiques, peut
aggraver le risque d'une dépendance psychique.
Des études in vitro suggèrent que le brotizolam est principalement métabolisé par biotransformation hépatique par le cytochrome P 450
(iso-enzyme 3A4). Dès lors, il faut tenir compte des interactions pharmacocinétiques qui peuvent modifier l'activité du brotizolam,
lorsque celui-ci est administré avec des substrats ou des inhibiteurs (p.ex. kétoconazole) de ce cytochrome.
La théophylline est un antagoniste de l’action pharmacologique des benzodiazépines et donc du brotizolam. La prise concomitante
d’alcool sera évitée, car elle provoque un renforcement de l’effet sédatif.
4.6 Grossesse et allaitement
La sécurité d'emploi pendant la grossesse et la lactation n'est pas démontrée. Aussi le LENDORMIN n'est-il pas recommandé
pendant la grossesse et la lactation.
Le profil pharmacologique du produit peut favoriser l'apparition chez le nouveau-né d'hypothermie, d'hypotonie et de dépression
respiratoire modérée.
De plus, les enfants nés de mères ayant pris chroniquement des benzodiazépines au cours des dernières semaines de la grossesse, sont
susceptibles de développer une dépendance physique.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Il convient d'avertir le patient que le traitement peut induire une certaine diminution de sa réactivité (sédation, amnésie, diminution de la
fonction musculaire), éventuellement accentuée par l'usage concomitant d'alcool ou d'autres dépresseurs du système nerveux central.
Il faut y être attentif pour toute activité requérant le maintien d'une vigilance suffisante.
Une diminution de la vigilance est d'autant plus probable que le sommeil est de durée insuffisante.
4.8 Effets indésirables
Pour la classification de la fréquence, la convention suivante a été utilisée:
Très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1000, < 1/100) ; rare (≥ 1/10 000, < 1/1000); très rare (<
1/10 000).
Classe de système d'organes Fréquence
Troubles psychiatriques:
émotivité atténuée: rare
révélation d'une dépression sous-jacente : peu fréquent
agitation : rare
nervosité : rare
irritabilité: rare
cauchemars: peu fréquent
troubles de la libido: rare
confusion : rare
Troubles du système nerveux:
somnolence diurne: fréquent
vigilance diminuée: rare
céphalées: fréquent
vertiges: peu fréquent
ataxie: rare

amnésie antérograde: rare
Troubles de la vue:
diplopie : rare
Troubles gastro-intestinaux: fréquent
Troubles hépato-biliaires:
altérations des tests de la fonction hépatique: rare
ictère: rare
Troubles cutanés et des tissus sous-cutanés:
réactions cutanées : rare
Troubles musculo-squelettiques et du tissu conjonctif:
faiblesse musculaire: rare
Troubles généraux et liés à l'administration:
fatigue : rare
réactions paradoxales: rare
symptômes de retrait: rare
effet rebond : rare
La plupart des effets indésirables observés sont liés à l'action pharmacologique du produit.
Les symptômes: somnolence diurne, émotivité atténuée, vigilance diminuée, confusion, fatigue, céphalées, vertiges, faiblesse musculaire,
ataxie ou diplopie se manifestent surtout en début de traitement et disparaissent habituellement en cours de traitement.
Une amnésie antérograde peut apparaître aux doses thérapeutiques. Ce risque augmente à des doses plus élevées. Ces effets sur la
mémoire peuvent être associés à un comportement inapproprié.
Si suite à l'utilisation du brotizolam à doses thérapeutiques de la nervosité, de l'agitation, de l'irritabilité et/ou des cauchemars sont
observés, on arrêtera le traitement.
Les symptômes de retrait ou de rebond peuvent annoncer l'installation d'une dépendance (voir aussi le paragraphe "Mises en garde
spéciales et précautions particulières d'emploi").
4.9 Surdosage
Symptômes:
Le surdosage entraîne habituellement un sommeil très profond qui peut confiner au coma, suivant la quantité ingérée.
L'ingestion de fortes doses de benzodiazépines combinée avec la prise d'alcool et d'autres médications (ou en cas de pathologie sous-
jacente) est une situation qui peut mettre la vie en danger.
Traitement:
On appliquera un traitement symptomatique: lavage gastrique et/ou administration de charbon suractivé, apport liquidien par voie
parentérale. En soins intensifs, on accordera une attention particulière aux fonctions respiratoire et cardiovasculaire. Le flumazénil
(Anexate®) peut être utile comme antidote.
Le flumazénil est indiqué en cas d’intoxication grave avec coma ou insuffisance respiratoire, il est contre indiqué lors de la prise d’anti-
dépresseurs tricycliques, la prise concomitante de médicaments pouvant entraîner des convulsions, anomalies de l’ECG telles qu’un
allongement de l’espace QRS ou de l’espace QT (qui font évoquer une suspicion de prise concomitante de tricycliques).
Diurèse et hémodialyse sont d'une utilité limitée en cas de surdosage "pur" aux benzodiazépines.
5. PROPRIÉTÉS PHARMACOLOGIQUES
Propriétés pharmacodynamiques
Classe pharmacothérapeutique: hypnosédatif.
Code ATC: N05C D09
Le brotizolam est une hétrazépine qui se lie spécifiquement et fortement aux récepteurs benzodiazépiniques au niveau du système
nerveux central. Il réduit le temps d'endormissement, le nombre de réveils nocturnes et augmente la durée totale du sommeil. Aux
doses recommandées, l'architecture du sommeil reste inchangée.
Propriétés pharmacocinétiques
Suite à l'administration orale d'un comprimé de 0,250 mg, le pic de concentration plasmatique est atteint après 1 heure (0,5 - 2,0) chez
les sujets jeunes et, chez les patients âgés, après 1,7 heures (0,5 - 3,0). La demi-vie d'absorption est de l'ordre de 10 minutes. La
biodisponibilité absolue est de 70%. La demi-vie d'élimination plasmatique se situe entre 3 et 6 heures. Elle est, chez les patients âgés,

de 9,1 heures en moyenne (4,0 - 19,5). La prise journalière de 0,250 mg de brotizolam n'entraîne ni accumulation, ni modification de la
demi-vie d'élimination chez les patients âgés.
La demi-vie moyenne d'élimination plasmatique est de 6,9 à 8,15 heures chez divers insuffisants rénaux (clairance de créatinine
inférieure à 15 ml/min.).
L'élimination du brotizolam peut parfois être freinée considérablement chez les patients atteints de cirrhose hépatique; la demi-vie
moyenne d'élimination dans une étude était de 12,8 heures (9,4 - 25).
La fraction non liée aux protéines est de 8,4% (± 0,7). Le volume de distribution après administration de 0,250 mg est de 0,66 l/kg (±
0,19). Les 2/3 environ de la dose totale administrée sont éliminés dans les urines, le reste dans les selles.
Le brotizolam est principalement métabolisé par biotransformation dans le foie par le cytochrome P450 (iso-enzyme 3A4). Les
métabolites principaux sont le 9-hydroxy-méthyl-brotizolam et le 6-hydroxy-brotizolam. Ces métabolites sont peu actifs sur le
récepteur benzodiazépinique.
A partir des mesures, par diverses méthodes, des taux plasmatiques de brotizolam et de ses métabolites, on a calculé les demi-vies
d'élimination des principaux métabolites; elles correspondent grosso modo à celle du brotizolam.
Données de sécurité pré-cliniques
Données non fournies.
6. DONNÉES PHARMACEUTIQUES
6.1 Liste des excipients
Lactose - Amidon de maïs - Carboxyméthylamidon sodique - Cellulose microcristalline - Stéarate de magnésium
6.2 Incompatibilités
Sans objet.
6.3 Durée de conservation
36 mois
L'abréviation "EXP." (date d'expiration), reprise sur l'emballage, annonce la date à partir de laquelle la validité du produit n'est plus
démontrée (les deux premiers chiffres indiquent le mois et les suivants l'année - la date d'expiration commence le dernier jour du mois
indiqué).
6.4 Précautions particulières de conservation
Conserver dans l'emballage d'origine, à une température ne dépassant pas 25°C.
Tenir hors de la portée et de la vue des enfants.
6.5 Nature et contenu de l’emballage
Petit comprimé blanc, sécable, gravé "13 A".
Boîte de 30 comprimés sous blisters. Conditionnement clinique de 300 comprimés sous blisters. Conditionnement clinique en
monodoses.
Toutes les présentations ne sont pas commercialisées.
6.6 Instructions pour l’utilisation et la manipulation
Aucune exigence particulière.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
SCS Boehringer Ingelheim Comm.V
Avenue Ariane, 16
B-1200 Bruxelles
8. NUMÉRO D’AUTORISATION DE MISE SUR LE MARCHÉ
205 IS 97 F 3
9. DATE DE PREMIÈRE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
A. Date de première autorisation: 20.03.1985
B. Date de renouvellement de l'autorisation: 20.11.2006
10. DATE DE DERNIERE MISE À JOUR/APPROBATION DE LA NOTICE

A. Date de dernière mise à jour du résumé des caractéristiques du produit: 05.02.2010
B. Date de l’approbation du résumé des caractéristiques du produit: 03.01.2011
STATUT LEGAL DE DELIVRANCE
Sur ordonnance médicale.
CLASSIFICATION ATC5
Classe Description
N05CD09 SYSTEME NERVEUX CENTRAL
PSYCHOLEPTIQUES
HYPNOTIQUES ET SEDATIFS
BENZODIAZEPINES
BROTIZOLAM
PRIX
Nom Conditionnement CNK Prix Rb Type Cat. Presc.
LENDORMIN 30 COMP 0,25MG 0893-891 € 13,77 D Original OR Oui
1
/
5
100%