bacteriologie medicale tropicale

Instituut voor Tropische Geneeskunde
Institut de Médecine Tropicale
Institute of Tropical Medicine
Instituto de Medicina Tropical
Nationalestraat, 155
B – 2000 Antwerpen
Stichting van Openbaar Nut 0410.057.701
POSTGRADUAT EN MEDECINE TROPICALE ET SANTE INTERNATIONALE
Module 1 & Module 2
BACTERIOLOGIE
MEDICALE
TROPICALE
___________
(Notes pratiques)
SEPTEMBRE 2009
Philippe Gillet – Luc Boel - Jan Jacobs

______________________________________________________________________________________________________________________________________________
Notes pratiques de bactériologie tropicale ver pg 22/02/2010 2 / 46
TABLE DES MATIERES
TABLE DES MATIERES....................................................................................................................................................................................................................1
INTRODUCTION....................................................................................................................................................................................................................................5
TECHNIQUES USUELLES EN BACTERIOLOGIE...............................................................................................................................................................6
COLORATION AU BLEU DE METHYLENE : ..............................................................................................6
PRINCIPE :................................................................................................................................................6
MATERIEL :...............................................................................................................................................6
METHODE :...............................................................................................................................................6
REPONSES TYPES..................................................................................................................................6
COLORATION A l’ENCRE DE CHINE .........................................................................................................7
PRINCIPE ET METHODE : .......................................................................................................................7
MATERIEL :...............................................................................................................................................7
METHODE :...............................................................................................................................................7
REPONSES TYPES :................................................................................................................................7
COLORATION DE GRAM.............................................................................................................................8
PRINCIPE :................................................................................................................................................8
MATERIEL :...............................................................................................................................................8
METHODE :...............................................................................................................................................8
REPONSES TYPES :................................................................................................................................9
INTERPRETATION DES RESULTATS :...................................................................................................9
CLASSIFICATION DES BACTERIES SUR BASE DE LEURS MORPHOLOGIES ET DE LEURS COULEURS AU GRAM .....11
COLORATION DE ZIEHL-NEELSEN A CHAUD : .....................................................................................12
PRINCIPE :..............................................................................................................................................12
MATERIEL :.............................................................................................................................................12
METHODE :.............................................................................................................................................12
TUBERCULOSE ...............................................................................................................................................................................................................................13
INTRODUCTION : ...................................................................................................................................13
CARACTERISTIQUES : ..........................................................................................................................13
LOCALISATIONS : ..................................................................................................................................13
PRÉCAUTIONS PARTICULIÈRES: ........................................................................................................13
DIAGNOSTIC MICROSCOPIQUE DE LA TUBERCULOSE PULMONAIRE :........................................13
PRISE D’ÉCHANTILLONS (TUBERCULOSE PULMONAIRE) : ............................................................13
TECHNIQUES DE CONCENTRATIONS : ..............................................................................................13
ETALEMENT DES CRACHATS :............................................................................................................13
DIAGNOSTIC DES TUBERCULOSES EXTRA-PULMONAIRES :.........................................................13
FIXATION DES ÉTALEMENTS :.............................................................................................................13
LA COLORATION DE ZIEHL NEELSEN À CHAUD ...............................................................................13
EXAMEN MICROSCOPIQUE DE LA PRÉPARATION :.........................................................................13
QUANTIFICATION DES RÉSULTATS :..................................................................................................13
INTERPRÉTATION DES RÉSULTATS :.................................................................................................13
CONTRÔLE DE QUALITÉ DES EXAMENS DE CRACHATS POUR BAAR :........................................13
CAUSES D’ERREURS TECHNIQUES : .................................................................................................13
CAUSES D’ERREURS NON TECHNIQUES : ........................................................................................13

______________________________________________________________________________________________________________________________________________
Notes pratiques de bactériologie tropicale ver pg 22/02/2010 3 / 46
EXAMEN D’UN LIQUIDE DE PONCTION :................................................................................................13
PRINCIPE :..............................................................................................................................................13
PRELEVEMENT :....................................................................................................................................13
REACTION DE RIVALTA : .....................................................................................................................13
PRINCIPE :..............................................................................................................................................13
MATERIEL :.............................................................................................................................................13
METHODE :.............................................................................................................................................13
REPONSES TYPES :..............................................................................................................................13
DIFFERENTIATION CELLULAIRES :....................................................................................................13
PRINCIPE :..............................................................................................................................................13
MATERIEL :.............................................................................................................................................13
METHODE :.............................................................................................................................................13
REPONSES TYPES :..............................................................................................................................13
INTERPRETATIONS DES RESULTATS : ..............................................................................................13
EXEMPLE DE STRATÉGIE DE DIAGNOSTIC POUR LES ASCITES (SELON P.A. REEVE).............13
LEPRE.....................................................................................................................................................................................................................................................13
INTRODUCTION : ...................................................................................................................................13
DIAGNOSTIC DE LA LÈPRE : ................................................................................................................13
QUANTIFICATION DES RÉSULTATS :..................................................................................................13
INTERPRÉTATION DES RÉSULTATS :.................................................................................................13
ULCERE DE BURULI ......................................................................................................................................................................................................................13
INTRODUCTION : ...................................................................................................................................13
MENINGITES........................................................................................................................................................................................................................................13
INTRODUCTION : ...................................................................................................................................13
PRELEVEMENT :....................................................................................................................................13
EXAMEN MACROSCOPIQUE : ..............................................................................................................13
EXAMEN MICROSCOPIQUE : ...............................................................................................................13
REPONSES TYPES :..............................................................................................................................13
VALEURS DE REFERENCES : ..............................................................................................................13
DOSAGE DES GLOBULINES PAR LA REACTION DE PANDY ..............................................................13
PRINCIPE :..............................................................................................................................................13
MATERIEL :.............................................................................................................................................13
METHODE :.............................................................................................................................................13
INTERPRETATION DES RESULTATS :.................................................................................................13
REPONSES TYPES :..............................................................................................................................13
UTILISATION DU MILIEU TRANS-ISOLATE (TI) :....................................................................................13
MATERIEL :.............................................................................................................................................13
METHODE :.............................................................................................................................................13
METHODE POUR LES TESTS D’AGGLUTINATION DE PARTICULES DE LATEX :.............................13
PRINCIPE :..............................................................................................................................................13
MATERIEL :.............................................................................................................................................13
METHODE :.............................................................................................................................................13
INTERPRETATION DES RESULTATS...................................................................................................13

______________________________________________________________________________________________________________________________________________
Notes pratiques de bactériologie tropicale ver pg 22/02/2010 4 / 46
EXAMEN D'UN PRELEVEMENT URETRAL........................................................................................................................................................................13
PRINCIPE :..............................................................................................................................................13
PRELEVEMENT :....................................................................................................................................13
METHODE :.............................................................................................................................................13
REPONSES TYPES :..............................................................................................................................13
INTERPRETATIONS DES RESULTATS : ..............................................................................................13
PREPARATION DES SOLUTIONS POUR LA BACTERIOLOGIE.............................................................................................................................13
1. ALCOOL ACETONE A 90 % (v /v) : .........................................................................................................................................13
2. ALCOOL ACIDE DE ZIEHL à 3 % v/v :....................................................................................................................................13
3. ACIDE SULFURIQUE A 20 % (v/v) :........................................................................................................................................13
4. BLEU DE METHYLENE :..........................................................................................................................................................13
5. CRISTAL VIOLET OU VIOLET DE GENTIANE : .....................................................................................................................13
6. FUCHSINE DE ZIEHL : ............................................................................................................................................................13
7. FUCHSINE DILUEE : ...............................................................................................................................................................13
8. LUGOL FAIBLE :.....................................................................................................................................................................13
9. REACTIF DE PANDY :.............................................................................................................................................................13
10. SAFRANINE :...........................................................................................................................................................................13
MICROPHOTOGRAPHIE DE QUELQUES BACTERIES D’INTERET MEDICAL...............................................................................................13

______________________________________________________________________________________________________________________________________________
Notes pratiques de bactériologie tropicale ver pg 22/02/2010 5 / 46
INTRODUCTION
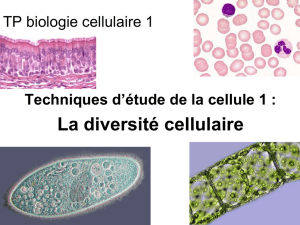
L’examen direct d’un étalement biologique contenant des bactéries n’est généralement pas suffisant pour
identifier l’espèce bactérienne en cause; seule la culture associée à une galerie d’identification biochimique
peut garantir une identification précise. Différentes particularités bactériennes expliquent cette limitation :
• Il existe un très grand nombre de germes différents.
• Les bactéries ont une taille limite pour la microscopie optique :
Epaisseur entre 0.2 et 2 µm,
Longueur entre 0.8 et 10 µm.
• Elles sont incolores à frais (et nécessitent donc des colorations particulières).
• Elles sont morphologiquement peu différentiables (coques – bâtonnets). Leur morphologie peut
même varier en fonction de certains paramètres (différentes souches, différents milieux de culture,
âge de la culture, patients immunodéprimés, traitement en cours, …).
• Il n’existe parfois aucune différence morphologique entre certains germes pathogènes et non
pathogènes (Neisseria meningitidis par exemple et les autres Neisseria).
• La virulence d’un germe est variable en fonction :
De sa localisation,
De la souche et de son sérotype,
Du nombre de germes envahissant une personne,
Du niveau de résistance du patient.
• Les échantillons sont souvent contaminés par des germes commensaux (endroits non stériles ou
contamination vraie).
Comme les cultures bactériennes ne sont pas (ou très peu) faisables au niveau d’un hôpital de district, seul
le prélèvement et l’envoi d’échantillon vers un laboratoire de référence est envisageable pour des cas bien
particuliers.
Ceci dit, l’examen microscopique direct d’un étalement, après coloration adaptée (Gram, Ziehl-Neelsen,
Giemsa, ...), est un moyen efficace pour déterminer la présence de bactéries dans un liquide normalement
stérile ou dans certains prélèvements particuliers.
• Dans les crachats pour identifier les formes infectieuses de tuberculose.
• Dans des liquides céphalo-rachidiens (L.C.R.), pour l’identification de la bactérie ou du champignon
responsable de la méningite.
• Dans des prélèvements opérés sur des hommes atteints d’urétrite à un stade précoce, les infections
gonococciques peuvent être diagnostiquées avec une certitude relative.
• Dans le sang pour identifier les fièvres récurrentes.
• …
La microscopie offre alors un diagnostic rapide, parfois [presque] exclusif (certaines tuberculoses, lèpre,
méningites bactériennes, anthrax, certaines borrélioses,…), parfois probable (gonocoque chez l’homme),
parfois partiel (coques Gram + / bâtonnets Gram – sur une urine par exemple), parfois différentiel (viral /
bactérien / autre étiologie).
Dans ces cas, l’examen direct après coloration appropriée peut donner des informations de grandes valeurs
pour le diagnostic, l’instauration immédiate d’un traitement approprié et le contrôle de certaines maladies.
Certains tests sérologiques simples, utilisables au niveau d’un laboratoire de district, peuvent aussi être
d’une grande utilité (syphilis, méningites bactériennes, …).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
1
/
46
100%