CHAP4 : L`atome et l`élément chimique

L’UNIVERS
Chap. 2 L’atome et l’élément chimique
TP1 – Transformation du fer 1
Activité expérimentale TP1 Transformations du fer
Objectifs : Pratiquer une démarche expérimentale pour vérifier la conservation des éléments au cours d’une
réaction chimique.
Mettre en œuvre des tests d’identification d’ions.
Problème : Jules est vraiment très maladroit ! Il vient de renverser du chocolat sur son compte rendu de chimie, celui-là même
qu’il doit rendre à la fin de l’heure. Il est à recommencer de toute urgence ! Plus embêtant encore, certaines taches masquent
ses principaux résultats d’expériences. Il faut donc les refaire !
Titre du TP : « Les éléments chimiques se conservent au cours d’une réaction chimique ». Comment le mettre en évidence avec
l’élément fer ?
Est-il chimiquement possible de retrouver le réactif fer de départ, même après lui avoir fait subir plusieurs
transformations chimiques ?
Document 1 L’élément chimique fer
o Beaucoup d’objets qui nous entourent sont constitués de fer métallique. L’élément fer se trouve également en nous : en
effet, le centre actif de notre hémoglobine est un ion Fer (II), noté Fe2+.
o Le fer est un métal gris, solide à la température ambiante. Il s’oxyde facilement à l’air libre en formant de la rouille ou à
chaud en formant de l’oxyde de fer FeO de couleur noire.
o L’élément fer se trouve aussi sous forme d’ions : l’ion fer II noté Fe2+ ou l’ion fer III noté Fe3+.
o Le test d’identification de ces ions est très simple : Il suffit de rajouter une solution d’hydroxyde de sodium (Na+ + HO-) et
d’observer le précipité. La couleur de ce dernier distinguera les deux hydroxydes de fer : Fe(OH)2 : hydroxyde de fer(II) ou
Fe(OH)3 : hydroxyde de fer(III).
Au cours des différentes expériences à réaliser, les espèces chimiques suivantes seront rencontrées :
Espèce chimique
Formule
Etat physique
Couleur
Le métal fer
Fe
Solide
Rouge
L’ion fer II
Fe2+
Solution liquide
Vert
L’ion fer III
Fe3+
Solution liquide
Orange
L’hydroxyde de fer II
Fe(OH)2
Solide
Vert
L’hydroxyde de fer III
Fe(OH)3
Solide
Rouille
L’oxyde de fer III
Fe2O3
Solide
Noir
Document 2 : Rappel : Transformation chimique
Système chimique : mélanges d’espèces chimiques.
Le système chimique subit une TRANSFORMATION CHIMIQUE lorsque son état évolue (d’un état initial vers un état final),
avec apparition de nouvelles espèces.
Ceci implique :
La CONSOMMATION d’une ou plusieurs espèces chimiques (présentes dans l’état initial) appelées REACTIFS
La FORMATION d’une ou plusieurs espèces chimiques (apparaissant dans l’état final) appelées PRODUITS
Document 3 : Aide méthodologique : Comment décrire les expériences ?
Observation et interprétation
Pour chacune des expériences de transformation de l’élément fer, il est demandé :
1 D’observer le milieu avant et après transformation : Décrire les observations sous forme de schémas légendés :
Le premier schéma pour décrire le milieu avant la transformation chimique,
Le second schéma pour décrire le milieu après transformation chimique ;
Bien observer ! Vous devez en effet, déterminer les réactifs disparus (pour cela bien lire l’intitulé de la transformation chimique
étudiée !) et identifier les produits formés (pour cela, faire des tests d’identification !)
2 Ecrire le bilan qualitatif correspondant à chaque expérience réalisée. Pour vous aider, compléter le diagramme :
Espèces chimiques présentes
avant la transformation
Espèces chimiques présentes
après la transformation

L’UNIVERS
Chap. 2 L’atome et l’élément chimique
TP1 – Transformation du fer 2
I . Consignes
Au cours de ce TP, vous allez étudier l’élément cuivre et réaliser des réactions chimiques permettant de passer d’une de ses formes
à une autre (voir le tableau ci-dessus).
Vous allez réaliser un protocole très précis en respectant à la lettre les consignes de sécurité. Vous ferez des schémas dans les
règles de l’art. Vous devrez ensuite analyser vos expériences et observations pour interpréter et conclure. La notion d’élément
chimique doit se dégager clairement. Pour valider votre travail vous pourrez compléter un diagramme et écrire si possible des
équations chimiques. Beaucoup de soin et de sérieux sont nécessaire pour ce TP, les actions doivent être coordonnées au sein du
groupe. Attention à la casse !
Sécurité
Nom de la substance chimique
Pictogramme
Risques
Conseils de prudence
Acide chlorhydrique
Soude
Eau oxygénée
Cyclohexane
Document 4 : Nom et Formule chimique des substances chimiques utilisées
Acide chlorhydrique (H+ + Cl-),
Soude ou hydroxyde de sodium (Na+ + HO-),
Chlorure de fer III en solution (Fe3+ + 3 Cl-),
Iodure de potassium en solution (K+ + I-),
Eau oxygénée 10 volumes (H2O2),
Poudre de fer (Fe),
Sulfate de fer II (Fe2+ + SO42-),
Eau distillée,
Cyclohexane.

L’UNIVERS
Chap. 2 L’atome et l’élément chimique
TP1 – Transformation du fer 3
II. Matériel
La verrerie :
Les solutions aqueuses :
Les solides :
Les solvants :
6 tubes à essais,
un tube « microbio »
un support tube à essais,
une spatule,
un agitateur,
un bécher (50 mL),
une pipette graduée (1 mL),
un pipeteur
Acide chlorhydrique (H+ + Cl-) (1 mol.L-1),
Hydroxyde de sodium ou Soude
(Na+ + HO-) (2 mol.L-1),
Sulfate de fer II (Fe2+ + SO4
2-)
Chlorure de fer III (Fe3+ + 3 Cl-),
Iodure de potassium (K+ + I-),
Eau oxygénée 10 volumes
Poudre de fer (Fe),
Oxyde de fer III (Fe2O3)
Eau distillée dans une
pissette,
Cyclohexane
III. Manipulations:
Penser à positionner les tubes de façon cohérente avant de commencer. Attention d’utiliser le matériel adéquat.
1. Action de l'acide chlorhydrique sur le fer métal :
Remarque : Les solutions seront directement versées dans le tube à essai. 1 mL = 1 cm3 donc 1 cm dans le tube à essai.
Verser environ 1 mL de solution aqueuse de sulfate de fer II dans le tube 1 qui servira de témoin.
Dans le tube n°2, introduire une spatule de poudre de fer. Ajouter avec précaution 2mL d’une solution d'acide chlorhydrique.
Laisser agir environ 4 minutes (pendant ce temps vous pouvez commencer à faire les schémas et à interpréter)
Dans le tube n°3, prélever ensuite environ 1 mL de la solution obtenue dans le tube n°2 (prélever uniquement le liquide sans le fer)
Ajouter sans agiter quatre gouttes de soude dans le tube 1 et le tube 3
Appeler le professeur et compléter votre compte-rendu
Interprétation de l’expérience
1. Sous quelle forme se trouve l’élément fer dans les réactifs de cette réaction chimique ? Donner le symbole de l’espèce chimique
2. Sous quelle forme se trouve l’élément fer dans les produits de cette réaction chimique ? Donner le symbole de l’espèce chimique
3. Qu’est-ce que ces deux formes ont en commun ?
4. Qu’est-ce que ces deux formes ont de différent ?
5. Que s’est-il passé au cours de la réaction chimique ? Ecrire l’équation de la demi-réaction concernant l’élément fer
2. Action de l’eau oxygénée sur une solution contenant des ions Fer II
Verser 1 mL d’une solution de chlorure de fer III dans le tube n°4 (tube témoin)
Dans le tube n°5, introduire 1 ml d’eau oxygénée. Ajouter 1 mL de la solution de sulfate de fer II. Laisser agir.
Ajouter quelques gouttes de soude dans le tube 4 et le tube 5
Appeler le professeur et compléter votre compte-rendu
Interprétation de l’expérience
6. Que s’est-il passé au cours de la réaction chimique ? Ecrire l’équation de la demi-réaction concernant l’élément fer
3. Action de l’iodure de potassium sur une solution contenant des ions Fer III
Verser 1 mL d’une solution de chlorure de fer III dans le tube microbio (avec bouchon) n°6 et ajouter 1 mL d’une solution
de iodure de potassium. Boucher et agiter.
Ajouter 1 mL de cyclohexane et agiter pour séparer la phase aqueuse de la phase organique.
Prélever 1mL de la solution aqueuse (phase inférieure) à l’aide d’une pipette graduée munie d’un pipeteur et introduire
dans le tube n°7 ; ajouter quelques gouttes de soude.

L’UNIVERS
Chap. 2 L’atome et l’élément chimique
TP1 – Transformation du fer 4
Regarder le diaporama : Fichier sur le site : Réaction entre Fe3+ et KI
Résultats de l’expérience
Si je mélange une solution de chlorure de fer III avec une solution de iodure de potassium alors j’observe que le mélange
devient brun, couleur due à la présence de diiode.
Si j’ajoute du cyclohexane et que j’agite alors j’observe peu à peu la disparition de la couleur brune et la formation de deux
phases : une violette au-dessus et une phase aqueuse au-dessous.
Après avoir prélevé la phase inférieure et l’avoir introduit dans le tube 7, si j’ajoute quelques gouttes de soude alors
j’observe la formation d’un précipité vert.
Interprétation de l’expérience
7. Que s’est-il passé au cours de la réaction chimique ? Ecrire l’équation de la demi-réaction concernant l’élément fer.
4. Action de l’aluminium sur l’oxyde de fer III
http://artic.ac-besancon.fr/lp_maths_sciences/labo/films/alumino/alumino.htm
8. Que s’est-il passé au cours de la réaction chimique ? Ecrire l’équation de la demi-réaction concernant l’élément fer sachant que
l’’oxyde de fer III est formé à partir de 2 ions fer II Fe3+ et de 3 ions oxyde O2-. La formule de l’oxyde de fer III est donc Fe2O3.
Toutes les expériences devront être schématisées et interprétées
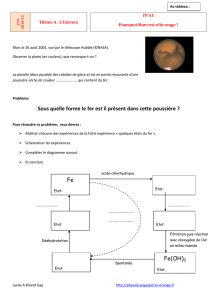
5. Compléter le cycle du fer
CONCLUSION : Qu’est-ce qu’un ELEMENT CHIMIQUE ? Qu’est-ce qui le caractérise?
L’………………………………………………………………, c’est ce qui est commun aux composés ci-dessus, sous des apparences différentes :
l’atome Fe (métal « gris »), les ions Fe2+(colorent les solutions en vert), les ions Fe3+ (colorent les solutions en orange), …
Compléter le tableau
Nb de
protons
Nb de
neutrons
Nombre
d’électrons
Fe
26
56
Cu2+
29
56
Fe
26
54
CONCLUSION A RETENIR :
Un élément chimique est caractérisé par son …………………………………………………………………. : il regroupe toutes les entités qui dans
leur ………………………………… possèdent le même nombre de ………………………….. .
A chaque élément, et donc à chaque…………………………………………………….…, on attribue un symbole.
Dans le symbole la 1ère lettre est toujours une majuscule. S’il y en a une seconde, c’est une minuscule.
Au cours d’une transformation chimique, des corps chimiques sont consommées, d’autres sont formées mais les éléments
chimiques ………………………………………………………
Exp. 1 : Action de l’acide chlorhydrique
Exp. 2 : Action de
l’eau oxygénée
Exp. 3 : Action de
l’iodure de potassium
Comparons des entités ne contenant que l’élément cuivre :
L’atome et l’ion diffèrent par le nombre d’……………………………
Les ……………………………diffèrent par le nombre de………………..
Atome, ion et isotopes d’un même élément possèdent le même
nombre de ………………………………………………………………………..
1
/
4
100%