Sous quelle forme le fer est il présent dans cette poussière ? Fe Fe

Lycée A Briand Gap http://physalp.pagesperso-orange.fr
2de9
2014-15
Thème A : L’Univers
TP A1:
Pourquoi Mars est-elle rouge ?
Mars le 26 août 2003, vue par le télescope Hubble (©NASA).
Observer la photo (en couleur), que remarque-t-on ?
La planète Mars possède des calottes de glace et est en partie recouverte d’une
poussière sèche de couleur …………………… qui contient du fer.
Problème:
Sous quelle forme le fer est il présent dans cette poussière ?
Pour résoudre ce problème, vous devrez :
Réaliser chacune des expériences de la Fiche expérience « quelques états du fer ».
Schématiser les expériences.
Compléter le diagramme suivant .
Et conclure
Fe
Etat:
Couleur :
Etat:
Couleur :
Fe(OH)3
Etat:
Couleur :
Etat:
Couleur :
acide chlorhydrique
…………………..
Filtration puis réaction
avec dioxygène de l’air
en milieu humide
Déshydratation
……………………
……...........………
………..........…….
…………..........….
Spontanée
Etat:
Couleur :
Etat:
Couleur :
Au tableau :

Lycée A Briand Gap http://physalp.pagesperso-orange.fr
On mélange en proportion
steochiométrique
Fe
2
O
3
et
Al
On pose le mélange homogène sur une
BRIQUE RÉFRACTAIRE .
Ces réactions sont utilisées
dans les feux d'artifices avec
divers oxydes métalliques
suivant la couleur recherchée.
Après la réaction violente de
réduction , on obtient du fer fondu
Fe
et une poudre blanche,
Al
2
O
3
l'alumine .
Fe
2
O
3
a été
RÉDUIT en
Fe
Al
a été
OXYDÉ
en
Al
2
O
3
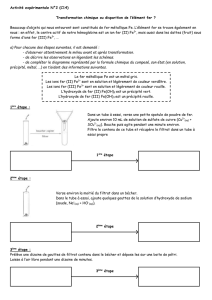
Expérience 1 :
Dans le tube à essai N°1, placer un peu de paille de fer puis environ 2mL d’acide
chlorhydrique concentré. Observer ce qu’il se passe et laisser reposer le tube.
(En attendant, schématiser l’expérience et commencer le compte rendu.)
Après quinze minutes environ, filtrer le contenu du tube à essai et observer la
coloration du filtrat dans le tube N°2. (on utilisera un tube témoin avec de l’eau
distillée).
La coloration est due aux ions fer (II) Fe2+.
Expérience 2 :
Verser goutte à gouttes quelques mL de soude concentrée dans le tube N°22.
Observation : …………………………………………………
Filtrer à nouveau pour récupérer le solide d’hydroxyde de fer (II) Fe(OH)2.
Expérience 3 :
Etaler le précipité obtenu précédemment sur une coupelle et le laisser au contact de l’air quelques minutes.
Observation :……………………………………………….
il se forme dans un premier temps de l’hydroxyde de fer (III) Fe(OH)3 puis celui-ci se transforme spontanément en oxyde
de fer (III) hydraté Fe2O3,H2O. Ces deux composés ont la même couleur.
Expérience 4 :
Placer la coupelle d’oxyde de fer (III) hydraté dans une étuve : L’oxyde de fer (III) se déshydrate.
Expérience 5 : Réalisé par le professeur (ou vidéo)
Un mélange de poudre d’oxyde de fer et de poudre d’aluminium est placé sur une brique réfractaire. La réaction est
amorcée par la combustion d’un ruban de magnésium. Il se forme un métal incandescent qui devient gris en
refroidissant et qui est attiré par un aimant.
FICHES DE SECURITE
Acide chlorhydrique
Soude (hydroxyde de sodium)
Fiche expérience « quelques états du fer »
Doc élève:

Lycée A Briand Gap http://physalp.pagesperso-orange.fr
Liste du matériel :
Paillasse professeur (aluminothermie):
Oxyde de fer Fe2O3 4 g
Poudre d’aluminium 1,35 g
Balance
Coupelle souple x2
spatule x2
bécher
Ruban magnésium
petit réchaud gaz
brique réfractaire + planche
Aimant
Ordi + videoprojecteur
élèves X8 :
Portoir + 6 Tubes à essai
paille de fer (ou limaille + spatule)
Petit flacon compte goutte d’acide chlorhydrique 3 mol.L-1
Petit flacon compte goutte de solution de soude 2 mol.L-1
Entonnoir + papier filtre x2
Coupelle
Goupillon
Au fond :
étuve
Application de l’aluminothermie http://wn.com/aluminothermie
1
/
3
100%