Des lésions pré-néoplasique à la métastase.

Cancérologie
04/11 de 16h à 17h Ahmadova Shams et Delalonde Fanny
Pr V Lindner
Des lésions pré-néoplasique à la métastase. Page 1 sur 15
Des lésions pré-néoplasique à la métastase.
Remarque : la prof a dit qu’à priori elle ne posera pas de question sur cette heure de cours (à
moins qu’elle soit tirée au sort). De plus les photos n’ont pas été incluses car elles n’apporteraient
rien en noir et blanc. Elles sont disponibles dans le diaporama.
I. Définitions
Lésion : altération morphologique des organes, des tissus ou des cellules, décelable par
tout moyen d’observation. C’est le signe des maladies
Pas de corrélation entre l’importance des lésions et son expression clinique ou biologique
Causes variées par exemples : génétique, infectieuse, physique, vasculaire, nutritionnelle,
métabolique, H, immunitaire, sénescence …
II. La démarche anatomo-pathologique
Corrélation anatomo-clinique
– Renseignements cliniques : permet d’orienter le diagnostique
– Biologie, par exemple : élévation sérique des marqueurs
– Imagerie : si on a une biopsie à analyser il nous manque des éléments macroscopiques tel
que la façon dont la tumeur siège dans l’organe, sa vascularisation, sa taille … L’imagerie
comble ces manques
Élaboration d’un diagnostic
Préciser le pronostic, par exemple : bénin ou malin
Préciser une prise en charge thérapeutique : via des réunions de cancérologie pluridisciplinaire
dans lesquelles sont présentés des cas différents pour discuter avant et après la prise en charge
Évaluer les effets thérapeutiques, par exemple selon le type histologique. Ainsi dans le cas d’un
cancer du poumon il sera proposé une chimiothérapie plutôt qu’une exérèse puis on attendra de
voir s’il y a récidive, disparition ou apparition de nouvelles lésions. En cas de nouvelles lésions il faut
savoir si c’est réellement une nouvelle lésion ou si elle était déjà présente mais non visible à
l’époque. De même on cherche à savoir si la tumeur nécrose ou si elle reste viable après
traitement.
III. En pratique… (exemple d’un bronchocarcinome)

Cancérologie
04/11 de 16h à 17h Ahmadova Shams et Delalonde Fanny
Pr V Lindner
Des lésions pré-néoplasique à la métastase. Page 2 sur 15
Un patient tousse. Il va chez son médecin traitant qui lui demande de passer une radiographie du
thorax. Sur la radio il apparait une boule : on se demande si c’est une tumeur, une inflammation ou
une embolie. On a donc une suspicion de tumeur. On demande alors au patient de faire une
endoscopie bronchique pour visualiser directement la possible tumeur.
On fait une biopsie et on l’envoie en anatomo-pathologie. Après observation au microscope il
apparait que c’est un broncho carcinome. Selon l’évolution du cancer on choisira une thérapie, par
exemple une lobectomie.
Dans le service d’anatomo-pathologie il est réalisé :
• Les prélèvements cytologiques (on frotte avec une brossette puis on dépose sur une lame) et
tissulaires
• L’enregistrement : N° d’identification
– Identité du patient
– Renseignements cliniques, endoscopiques, biologiques et d’imagerie
– Antécédents : autres cancers, métastase ou primitif
• Les techniques d’étude des cellules et des tissus
Quelques mots sur les techniques des tissus
Le but est de faire des tranches dans la pièce opératoire après l’avoir peser et mesurer. On prend la
pièce opératoire et on la divise en plusieurs prélèvements que l’on met dans des K7. Ces K7 seront
mises dans un VIP et passeront dans différents bains afin d’obtenir un bloc de paraffine que l’on
pourra découper. Le traitement permet de se débarrasser de l’eau et du formol (dans lequel on avait
mis les tissus pour éviter qu’ils pourrissent) ainsi : l’alcool permet l’extraction de l’eau, le xylène
permet l’extraction des graisses et la paraffine chaude permet la solidification.
Une fois le bloc d’inclusion obtenu on le met dans un microtome qui via une lame de rasoir permet
d’obtenir les lames. Après si on veut colorer le prélèvement il faut retirer la paraffine. Enfin on peut
regarder au microscope.
IV. Définition d’une tumeur
A. Ancienne définition de la tumeur
Toute augmentation de volume localisée d’un organe ou d’une région du corps. Mais cela
correspondait à des processus pathologiques de nature différente. Par exemple : tumeur vraie
(néoplasie), pseudo-tumeur inflammatoire, hamartomes, hyperplasie et hypertrophie.
B. Définition actuelle
Le terme tumeur est employé au sens de néoplasme ou néoplasie soit toute nouvelle formation
tissulaire correspondant à une prolifération cellulaire excessive.
Le tissu tumoral est ± ressemblant au tissu normal homologue (adulte ou embryonnaire) dont il
dérive.

Cancérologie
04/11 de 16h à 17h Ahmadova Shams et Delalonde Fanny
Pr V Lindner
Des lésions pré-néoplasique à la métastase. Page 3 sur 15
C. Points clés de la définition
• prolifération cellulaire excessive
• aboutissant à une masse tissulaire
• échappant aux règles biologiques de la croissance et de la différenciation cellulaire
(autonomie biologique)
• persistance et accroissement après cessation de la cause (donc si un fumeur arrête de fumer
cela n’empêche pas une tumeur de se former)
D. Notion de clonalité
• clone : ensemble de cellules dérivées d’une seule cellule initiale
• Tumeur
– monoclonale à partir d’une seule cellule
– oligoclonale de quelques cellules
– polyclonale d’un groupe de cellules
V. Tumeur bénigne, tumeur maligne
Tumeur bénigne
Tumeur maligne
Bien limitée
Mal limitée
Encapsulée
Non encapsulée
Semblable au tissu d’origine
Plus ou moins semblable
Cellules régulières
Cellules irrégulières
Croissance lente
Croissance rapide
Refoule sans détruire
Envahit les tissus voisins
Pas de récidive
Récidive
Pas de métastases
métastases
Cependant il n’y a jamais de limites nettes et il existe des exceptions :
• Continuum entre tumeurs bénignes et malignes :
la progression tumorale correspond à l’acquisition progressive par la tumeur d’un phénotype de
malignité et d’anomalies chromosomiques , par exemple : adénomes et adénocarcinome
• Tumeurs bénignes avec agressivité locale et générale :
- fibromatose = prolifération très importante de tissu conjonctif qui infiltre les tissus voisins
- méningiome métastasant
• Tumeurs malignes à malignité locale
- carcinome basocellulaire cutané : il n’entraine pas de tumeurs ganglionnaires
- gliome cérébral
• Nature bénigne ou maligne ?
parfois on est obligé d’attendre l’apparition de métastases pour savoir. Exemple :
corticosurrénalome endocrine

Cancérologie
04/11 de 16h à 17h Ahmadova Shams et Delalonde Fanny
Pr V Lindner
Des lésions pré-néoplasique à la métastase. Page 4 sur 15
VI. Composition d’une tumeur
• Cellules tumorales
• Stroma = tissu de soutien avec cellules et substances
o ne présentant pas les anomalies génétiques des cellules tumorales
o vascularisé
o il existe des textures différentes, par exemple : stroma fibro-inflammatoire, stroma
lymphocytaire, stroma fibreux avec de nombreuses cellules conjonctives
o parfois absent (cancer rein, prostate …)
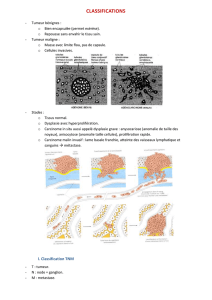
VII. Classification des tumeurs
A. Bases de la classification
• Elle est fondée sur:
- sur le caractère bénin ou malin de la tumeur
- sur la différenciation
• On peut s’aider (en particulier en cas de malignité) :
– de colorations spéciales
– de l’immunohistochimie
– de la biologie moléculaire
– de la cytogénétique
B. Organisation tissulaire normale
C. Détermination
• Préfixe = origine cellulaire
- ex : adéno- : tumeur glandulaire
- ex : léiomyo- : tumeur musculaire lisse …

Cancérologie
04/11 de 16h à 17h Ahmadova Shams et Delalonde Fanny
Pr V Lindner
Des lésions pré-néoplasique à la métastase. Page 5 sur 15
• Suffixe - «ome » = nature bénigne
- ex : adénome, léiomyome
• Suffixe - « carcinome (épithéliale) ou sarcome (mésenchymateuse)»
= nature maligne
- ex : adénocarcinome, léiomyosarcome
• Précision possible de l’origine tissulaire
- ex : adénome colique, thyroïdien …
D. Tableau recensant les différentes tumeurs
Tissu d’origine
Tumeur bénigne
Tumeur maligne
Epithélium
malpighien
papillome
Carcinome malpighien
glandulaire
Adénome
Adénocarcinome
Mésenchyme
Conjonctif
Fibrome
Fibrosarcome
Musc lisse
Léiomyome
Léiomyosarcome
Musc strié
Rhabdomyome
Rhabdomyosarcome
Nerveux
Schwanome
Schwanosarcome
Vasculaire
Hémangiome
Angiosarcome
Adipeux
Lipome
Liposarcome
Cartilage
Chondrome
Chondrosarcome
Os
Ostéome
Ostéosarcome
Mélanocytes
Naevus
Mélanome malin
T hématopoïétique
Lymphome ….
Parmi les tumeurs issues de l’épithélium on retrouve aussi les tumeurs excréto-urinaire pour la vessie.
( les photos sont sur le diaporama du prof)
VIII. Type histologique
Il existe différents types histologiques dans chaque classe de tumeur. Déterminer le type a
une valeur pronostic , par exemple les cancers à grandes cellules sont plus agressif, donc
pronostic plutôt mauvais.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%