OLYMPIADES DE LA CHIMIE 2006 Thème

1
OLYMPIADES DE LA CHIMIE 2006
Académie de Clermont-Ferrand
Durée : 2 heures
Thème :
Chimie et habitat
Avertissement :
Le sujet est volontairement
long. Les parties sont indépendantes
(sauf pour un nombre limité de
questions) et peuvent être traitées
dans un ordre indifférent.
Dans une même partie, les
questions peuvent être de difficulté
très variable.

2
Le bois est un matériau très présent dans la construction. C’est un
matériau « naturel » mais son utilisation fait appel à la chimie, à la fois pour
améliorer ses qualités (résistance à l’eau, au feu, aux insectes,…), l’esthétique
(vernis, peintures). La chimie permet de le transformer en matériaux dérivés par
addition de liants (bois aggloméré, lamellé-collé, contre-plaqué,…) pour
lesquels on trouvera un grand champ d’applications dans l’habitat.
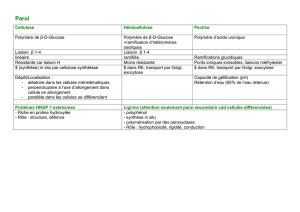
1ère partie : la composition du bois
D’une manière générale, quelle que soit l’essence considérée, les constituants
essentiels du bois sont :
- la cellulose (40 à 50 %)
- la lignine (25 à 30 %)
- les hémicelluloses (25 à 40%)
La cellulose a (dans l’espace) la structure suivante :
Les liaisons en trait gras sont situées à l’avant du plan de la feuille.
La cellulose est un des composés organiques les plus abondants sur la Terre ;
c’est le constituant de toutes les plantes fibreuses.
1. Quelle fibre textile est constituée de cellulose quasiment pure ?
2. Quel atome y a-t-il derrière le trait ondulé à droite sur la représentation de la
cellulose ?
3. Déduire de la représentation de la cellulose sa formule (CxHyOz)n : on donnera
les valeurs les plus petites possibles de x, y et z.
4. Pour le carbone marqué d’un •, compléter sur le document réponse les
représentations spatiales proposées ci-après en indiquant les atomes manquants
auxquels le carbone est lié :
O
O
O
O
O
O
OH
HO
HO
HO
CH2OH
CH2OH
CH2OH
OH
OH
•
O
O
O
CH2OH
CH2OH
CH2OH

3
La composition chimique élémentaire de la matière organique bois varie très
peu d’une essence à l’autre. En moyenne, elle se répartit, en pourcentage du
poids anhydre, de la façon suivante :
- carbone C 50 %
- oxygène O 43 %
- hydrogène H 6 %
- azote N 1 %
- cendres < 1 %
On rappelle les masses molaires atomiques :
M(C) = 12 g.mol-1 ; M(H) = 1 g.mol-1 ; M(O) = 16 g.mol-1
5. Que signifie le qualificatif « anhydre » ?
6. Pourquoi s’intéresse-t-on au poids anhydre ?
7. Quel pourcentage massique de carbone la cellulose contient-elle ? Détailler le
calcul effectué.
La lignine est un polymère extrêmement complexe, formé à partir de monomères
dont la formule est la suivante :
HOCH2-CH=CH OH avec R1, R2 = H ou OCH3
8. Combien, au total, y a-t-il de monomères différents constituant la lignine ?
9. Représenter le stéréoisomère (E) du monomère pour lequel R1 = R2 = H.
10. Sur le schéma du document réponse (qui propose une partie possible de
lignine), entourer les 4 fragments issus d’un même monomère et indiquer ce que
sont R1 et R2.
2ème partie : protection du bois contre les champignons, attaques de larves
et insectes.
Du fait de sa constitution, et pour éviter toute détérioration due à une action
extérieure, le bois doit subir un traitement par des produits fongicides et
insecticides. Le traitement peut être fait par une solution aqueuse (contenant les
substances actives) ou un solvant organique.
On utilise par exemple le sulfate de cuivre, très soluble dans l’eau, comme
fongicide : le bois à protéger est imprégné d’une solution aqueuse de sulfate de
cuivre, puis, à l’aide de diméthyldithiocarbamate de sodium, un complexe est
formé dans le bois entre le cuivre et le diméthyldithiocarbamate.
R2
R1

4
11. Le sulfate de cuivre étant de lui-même un fongicide efficace, pourquoi
forme-t-on un complexe ?
Une solution aqueuse de diméthyldithiocarbamate de sodium (SDDC de
masse molaire M = 143,2 g.mol-1) a une densité à 20°C de 1,18 et un pH de 9,4
pour une teneur massique comprise entre 40 et 42 % selon des données
commerciales. La même fiche de données mentionne que c’est un biocide utilisé
notamment dans la fabrication du papier ou le traitement des eaux usées.
Voici la formule du diméthyldithiocarbamate : N C
12. Que signifie le mot « biocide » ?
13. Quel rôle le SDDC peut-il jouer dans la fabrication du papier comme dans le
traitement des eaux usées ?
14. Le diméthyldithiocarbamate est-il acide ou basique ? Donner la formule
semi-développée de la forme acido-basique conjuguée de ce composé.
15. Donner un encadrement de la valeur de la concentration de la solution
aqueuse commerciale de SDDC.
On réalise un dosage acido-basique avec suivi pH-métrique d’une
solution commerciale de SDDC. Le réactif titrant est une solution d’acide
chlorhydrique de concentration 1,00.10-1 mol.L-1. Pour cela, on dilue 10 fois la
solution commerciale et on en prélève 5,00 mL. L’exploitation du dosage
conduit à la mesure d’un volume équivalent égal à 17,0 mL.
16. Quel matériel proposez-vous d’utiliser pour réaliser la dilution voulue ?
17. Que vaut la concentration de la solution commerciale dosée ? Commenter.
18. Quelle est l’allure correcte de la courbe de dosage pH-métrique (entourer la
bonne proposition sur le document réponse) ?
a. b. c. d.
En présence de zinc, le diméthyldithiocarbamate donne un précipité de
formule :
S-
S
H3C
H3C
pH
v
pH
v
pH
v
pH
v

5
19. Ecrire l’équation-bilan de la réaction de précipitation qui a lieu si on ajoute
du chlorure de zinc à une solution de SDDC.
Les insecticides utilisés sont extrêmement nombreux ; on trouve par exemple
dans la famille des carbamates (en représentation topologique) :
carbaryl propoxur
20. Entourer sur les formules du carbaryl et du propoxur du document réponse la
fonction carbamate.
21. Que désigne « thio » dans diméthyldithiocarbamate ?
22. Donner la formule du carbonate de sodium solide.
23. La fonction carbonate est assez semblable à la fonction carbamate. Entourer
sur le document réponse la formule générique correcte d’un composé possédant
la fonction carbonate.
24. Donner la formule brute du carbaryl.
Voici 2 voies de synthèse du carbaryl :
Voie 1 :
+ CH3NCO (méthylisocyanate)
Voie 2 :
+ Cl-C-NH-CH3
25. Connaissant le nombre usuel de liaisons formées par les atomes C, N et O,
entourer sur le document réponse la bonne proposition de formule semi-
développée du méthylisocyanate.
26. Donner l’équation-bilan de la formation du carbaryl par la voie 2.
27. Entourer (sur le document réponse) les atomes qui forment une liaison dans
la synthèse du carbaryl.
OH
OH
O
 6
6
 7
7
 8
8
 9
9
1
/
9
100%