HEMORRAGIE SOUS-ARACHNOIDIENNE: UNE URGENCE

HEMORRAGIE SOUS-ARACHNOIDIENNE:
UNE URGENCE DIAGNOSTIQUE ET THERAPEUTIQUE.
L’hémorragie méningée représente 5 à 10% des accidents vasculaires cérébraux. Dans 85% des cas, l’origine du
saignement est secondaire à la rupture d’une malformation vasculaire: l’anévrisme intracrânien. Deux facteurs
principaux influencent la mortalité: l’âge et l’état de conscience à l’admission à l’hôpital. La mortalité est de l’ordre de
25%, tout âge confondu. La principale cause de mortalité et morbidité est l’ischémie cérébrale retardée.
CIRCONSTANCES DE DIAGNOSTIC:
Un maître-symptôme:
- la céphalée brutale, explosive, remarquable par son intensité. Il est exceptionnel que le patient ne
puisse pas préciser l’heure ou l’activité qu’il était en train de réaliser au moment de sa survenue. Cette céphalée,
conséquence de l’augmentation de pression intracrânienne, est contemporaine de l’irruption de sang dans les espaces
sous-arachnoïdiens.
Autres circonstances
- La céphalée ictale
- Le malaise suivi d’une perte de connaissance brève ou d’un coma
- La crise convulsive inaugurale
- Un arrêt cardio-respiratoire dans 10% des cas
Mais la symptomatologie peut-être moins typique. L’hémorragie méningée peut mimer:
- une gastro-entérite
- un syndrome grippal
- une sinusite
- un torticolis
Un bon interrogatoire permettra de redresser le diagnostic en retrouvant la notion d’un épisode céphalalgique brutal
initial.
Un contexte évocateur:
- changement de position,
- effort physique
- situation émotionnelle intense.
Près de 25% des patients présentent un épisode de céphalées inhabituelles (“ sentinel headache ”) dans les 15 jours
précédent l’épisode hémorragique aigu. Cette épistaxis méningée, évocatrice d’un saignement mineur dans les espaces
méningés, doit être recherché à l’interrogatoire, car elle conditionne en partie la programmation des examens
complémentaires.
En pratique:
Le caractère brutal de la céphalée est un élément essentiel du diagnostic clinique. Malgré une histoire clinique
caractéristique, la méconnaissance ou le retard de diagnostic reste trop fréquent (20 à 25%)....
SIGNES CLINIQUES CLASSIQUES D’ACCOMPAGNEMENT
- Nausées, vomissements
- Photophobie

- Prostration
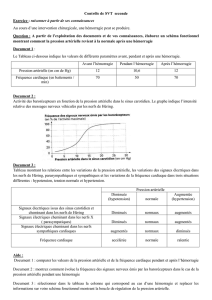
- Hypertension artérielle: elle est fréquemment observée au cours des premières heures d’une HSA.
Avant toute correction, il est essentiel d’identifier et contrôler les facteurs susceptibles de la favoriser: céphalées,
hypercapnie, agitation liée à une hypoxémie, hypertension artérielle au décours de la phase post-critique d’une
convulsion. Seule l’hypertension artérielle confirmée sera traitée car elle pourrait favoriser la récidive hémorragique. Sa
correction doit être très prudente, car une chute trop brutale favoriserait l’ischémie cérébrale. L’objectif thérapeutique
est de maintenir une pression artérielle à des chiffres de 140 à 150 mm de Hg de maxima. L’administration de
l’inhibiteur calcique nimodipine, faisant partie intégrante de la prise en charge thérapeutique de l’hémorragie méningée
par rupture de malformation anévrysmale, le traitement de l’hypertension artérielle devra faire appel à une autre classe
d’agents antihypertenseurs. Les diurétiques, responsables d’une déplétion hydro-sodée sont à éviter.
DONNEES DE L’EXAMEN CLINIQUE
- Raideur de nuque liée à la contracture réflexe des muscles paravertébraux. Elle peut-être absente à la
phase précoce de l’hémorragie méningée
- Signe de Kernig: l’élévation des membres inférieurs s’accompagne d’une flexion des genoux, ou
impossibilité du patient à s’asseoir dans son lit sans fléchir les genoux
- Signe de Brudzinski: la flexion antérieure de la nuque s’accompagne d’une flexion des genoux.
- Réflexes ostéo-tendineux vifs, parfois diffusés
- Réflexe cutanéo-plantaire en extension
- Déficit moteur complet ou incomplet, troubles de la parole
- Etat de conscience d’après l’échelle de coma de Glasgow
- Recherche d’une atteinte oculaire. Noter l’existence d’un strabisme interne uni ou bilatéral (perte de
l’abduction de l’oeil), traduisant une atteinte du nerf moteur oculaire externe (VIè paire) qui n’a pas de valeur
localisatrice cependant. Cette atteinte n’a pas de valeur pronostic.
La présence d’une mydriase unilatérale partielle (inégalité pupillaire) ou complète (absence de réflexe photo-moteur,
perte de toute motricité oculaire en dehors de l’abduction, ptosis), traduit une atteinte du nerf moteur oculaire commun
(IIIè paire). En l’absence de troubles de la conscience, cette atteinte est généralement secondaire à la compression du
nerf par un anévrisme de la face postérieure de la carotide; en présence d’un coma, cette mydriase uni ou bilatérale
traduit un engagement temporal (compression latérale du tronc cérébral).
Ces éléments cliniques sont importants à rechercher, car une fois le diagnostic positif d’hémorragie sous-arachnoïdienne
établi, ces données vont permettre de classer le patient suivant la classification de la World Federation of
Neurosurgeons (WFNS), qui a une valeur pronostic. Cette classification tient compte de l’échelle de coma de Glasgow
et de l’existence ou non d’un déficit neurologique. Le pronostic sera d’autant meilleur que le grade WFNS est bas
(Classes I ou II).
Facteurs de risque:
Le tabagisme est un facteur de risque hautement probable. On ne sait cependant pas s’il agit à court terme ou long
terme.
L’hypertension artérielle, est un facteur de risque clairement identifié dans les accidents vasculaires hémorragiques au
sens large. Son rôle dans l’hémorragie sous-arachnoïdienne est reconnue de façon récente.
La prise de contraceptif oraux n’apparaît pas comme un facteur de risque clairement identifié.
Le diabète n’est pas un facteur de risque dans cette pathologie.

Facteurs pronostics :
- L’âge : la mortalité est d’autant plus élevée que l’âge est avancé. Elle avoisine 40 % pour les plus de 60 ans et
20% pour les moins de 60 ans.
- L’état de conscience à l’admission à l’hôpital. Le pronostic est d’autant plus sombre que le score de Glasgow
est bas ou que le grade de la classification WFNS est élevé. Les chances de survie sont de l’ordre de 87 % chez le
patient conscient et se réduisent à 28% lorsqu’il existe un coma.
- La quantité de sang détectée par la tomodensitométrie cérébrale (Classification de Fischer)
En pratique :
Devant toute suspicion clinique d’hémorragie sous-arachnoïdienne, la démarche diagnostique doit être conduite
sans délai inutile.
DEMARCHE DIAGNOSTIQUE
LE DIAGNOSTIC POSITIF
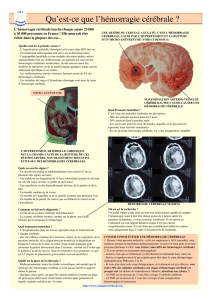
- La tomodensitométrie cérébrale, sans injection de produit de contraste, est l’examen de choix, et doit être
l’examen de première intention.
Cet examen atraumatique, confirme le diagnostic dans près de 92% des cas, s’il est réalisé dans les 48 heures. Il peut
cependant méconnaître une épistaxis méningée, et sa sensibilité diminue après le premier jour (50% à J2, 7,2% 0 J7). Il
renseigne sur la localisation de l’hémorragie, son importance, son retentissement sur les structures cérébrales, sur
l’existence d’un hématome intra-parenchymateux, d’une hémorragie intra-ventriculaire associée, d’une hydrocéphalie,
de signes indirects d’hypertension intracrânienne (diminution des sillons corticaux, diminution ou disparition des
citernes de la base, déviation de la ligne médiane). La distribution de l’hémorragie méningée peut suggérer la
localisation probable de la malformation vasculaire.
Cet examen ne présente pas de contre-indications en soit, mais ne doit être réalisé que chez un patient calme, dont les
fonctions respiratoire et cardio-vasculaire sont contrôlées. Il doit être réalisé sans injection de produit de contraste.
Un examen tomodensitométrique normal n’exclut pas le diagnostic, en cas de forte suspicion clinique et doit
inciter à poursuivre les investigations complémentaires.
- La ponction lombaire
Elle n’est en aucun cas l’examen de première intention. Elle est réalisée chez un patient ayant une histoire clinique
fortement évocatrice d’hémorragie méningée et dont le diagnostic positif n’a pas pu être prouvé par la
tomodensitométrie cérébrale. Le liquide céphalo-rachidien est habituellement recueilli dans trois tubes en vue d’un
examen cytologique, chimique et bactériologique. Le LCR est rouge, rose ou xanthochromatique (coloration du LCR
par des pigments jaunes suite à l’hémolyse des globules rouges) en fonction du délai entre le saignement méningé et la
ponction. En cas de geste traumatique, la centrifugation du LCR permet d’obtenir un surnageant clair, jamais
xantochromique. Après ponction traumatique, cet examen ne sera pas renouvelé avant 24 à 48 heures.
Contre-indications:
- Troubles de la coagulation
- Atteinte infectieuse cutanée de la zone à ponctionner
- Risque d’engagement cérébral (syndrome de masse, hydrocéphalie obstructive à la TDM)
- Signes de localisation (contre- indication théorique)

Résonance Magnétique Nucléaire cérébrale (RMN): cet examen manque de sensibilité à la phase aiguë, et n’est pas
recommandé en urgence. Par ailleurs, l’éloignement du site par rapport au service d’urgence, la difficulté de
surveillance des patient et la durée de l’examen, en limitent les indications.
En pratique :
Tout patient ayant une histoire clinique évocatrice d’une hémorragie méningée doit bénéficié d’une stratégie
diagnostique en urgence. L’examen de première intention est la tomodensitométrie cérébrale. Toute impossibilité
de confirmer le diagnostic en urgence impose le transfert du patient vers une structure ayant le plateau
technique requis. Son admission en milieu neurochirurgical s’impose, dès lors que le diagnostic est confirmé.
DIAGNOSTIC ETIOLOGIQUE
Artériographie cérébrale
Elle est à l’heure actuelle, le seul examen permettant la recherche étiologique d’une hémorragie méningée: anévrisme le
plus souvent, malformation artério-veineuse plus rarement. Elle concernera les quatre pédicules artériels à destinée
cérébrale (2 carotides et 2 vertébrales), car dans près de 20 % des cas, les localisations anévrismales sont multiples. Cet
examen traumatique, réalisé fréquemment sous anesthésie générale, est classiquement effectué au cours des quatre
premiers jours de l’hémorragie méningée, ou après le dixième jour. Entre le 4è et 10è jour, il favoriserait la
survenue d’un vasospasme. Cet examen renseigne sur la localisation, le nombre, la taille, l’aspect du collet de la
malformation. Dans près de 15% des cas, l’origine du saignement ne peut être démontré: il est alors recommandé de
prévoir une nouvelle artériographie dans un délai de un mois suivant le saignement initial. Cet examen n’est pas sans
risque: morbidité: 0,5%, mortalité:1,5%. Il est rarement réalisé après 75 ans. L’allergie à l’iode n’est pas une contre-
indication mais nécessite certaines précautions spécifiques pour le patient.
Angio-TDM des troncs supra-aortiques et du polygone de Willis
L’avènement des scanners de nouvelle génération (Scanners multibarettes) permet de réaliser, dans le cadre de
protocoles rigoureux, des angio-TDM avec analyse des troncs supra-aortiques et du polygone de Willis. Cet examen
renseigne sur l’existence ou non de malformation vasculaire anévrysmale, sur leur localisation et sur l’aspect du collet,
élément très important dans le choix de l’approche thérapeutique possible (exclusion par voie chirurgicale ou
embolisation par radiologie interventionnelle). Il est réalisé dans le même temps que le scanner sans injection, lorsque
ce dernier confirme l’existence d’une hémorragie méningée. Sauf cas particulier, une angio-TDM négative, ne
nécessitera pas d’artériographie.
AngioRMN: dans un avenir proche, elle pourrait représenter un examen de choix pour les diagnostics positif et
étiologique de l’HSA; à ce jour, sa place reste mal définie dans le cadre de l’urgence: sa sensibilité et spécificité restent
à préciser. Elle reste cependant l’examen à privilégier dans le cas des artériographies blanches, et sera proposée vers le
10ième jour.
Examens complémentaires à réaliser systématiquement:
- Radio pulmonaire : elle fait partie du bilan systématique, permettant une étude de la silhouette cardiaque
(recherche d’une cardiomégalie, d’une hypertrophie ventriculaire gauche) et du parenchyme pulmonaire (syndrôme

alvéolaire: pneumopathie d’inhalation?, oedème aigu du poumon?)
- ECG: des anomalies électrocardiographiques à la phase précoce de l’HSA sont observées chez près de 60%
des patients: tachyarythmies suprventriculaires ou ventriculaires, troubles de la repolarisation, allongement du QT. Elles
sont probablement secondaires à la décharge de catécholamines contemporaine de l’HSA. (Tracé ECG systématique).
Toute anomalie sera couplée à un dosage biologique des enzymes cardiaques.
- Bilan sanguin standard : NFS, Ionogramme, Bilan de coagulation, Groupe, rhésus, recherche d’agglutinines
irrégulières, phénotype chez la femme en âge de procréer et les enfants. Une hyperleucocytose est fréquemment
observée, et peut-être expliquée par l’orage catécholaminergique accompagnant la rupture.
COMPLICATIONS CLASSIQUES ET PRECOCES
- La récidive hémorragique. Ce risque existe tant que la malformation vasculaire est présente. Maximum au
cours du premier jour (4 %), il existe un risque cumulatif moyen de resaignement de 1,5 % par jour, au cours du
premier mois. La mortalité avoisine les 60 à 80 %.
Sur le plan clinique, la symptomatologie est toujours brutale: recrudescence des céphalées, troubles végétatifs, troubles
de la conscience, déficit neurologique, crise convulsive. La TDM cérébrale confirmera la récidive hémorragique.
Le traitement médical préventif a longtemps fait appel :
- au repos,
- au contrôle de la pression artérielle,
L’administration d’agents antihypertenseurs n’est envisageable qu’après correction de tous les facteurs susceptibles de
favoriser une hypertension artérielle. Sa correction (chiffres > 160/90 mm Hg à trois reprises) doit être progressive sous
contrôle continue des paramètres hémodynamiques et surveillance neurologique rapprochée. L’administration des
antihypertenseurs sera de préférence intraveineuse avec relais au pousse seringue. Les diurétiques, favorisant la
déplétion hydro-sodée sont à éviter.
- à la prescription précoce d’antalgiques, systématiquement et à doses efficaces.
Attention aux dérivés morphiniques (nalbuphine, buprénorphine..) qui peuvent modifier l’état de conscience ainsi qu’
aux AINS, compte-tenu de leur action sur les plaquettes. La prescription de morphiniques tel le fentanyl en continue
doit être exclu en l’absence de ventilation mécanique.
Le traitement radical de cette complication reste l’exclusion chirurgicale de la malformation, ou son traitement par
voie endovasculaire.
- Le vasospasme, responsable du syndrome d’ischémie cérébrale retardée. C’est une complication redoutable,
qui représente la première cause de mortalité et morbidité chez ces patients. Un patient sur deux présentera un
vasospasme à l’artériographie, qui évoluera dans près de 30% des cas vers un vasospasme symptomatique. Ce dernier
se compliquera dans 50% d’un infarctus cérébral responsable de décès ou de séquelles lourdes.
Classiquement, il apparaît entre le 4è et 10è jour après la rupture. Sur le plan clinique, il faut y penser devant : une
aggravation des céphalées, l’apparition progressive d’une désorientation ou d’une confusion, l’installation d’un déficit
neurologique moteur ou de trouble du langage. Il est essentiel à ce stade d’éliminer un resaignement, une hydrocéphalie
ou des troubles électrolytiques (hyponatrémie). Un contrôle tomodensitométrique s’impose en urgence. Le diagnostic
est fait sur l’artériographie ou à partir des données du Doppler transcrânien. Ce dernier examen atraumatique permet de
mesurer la vélocité du débit sanguin cérébral au niveau des artères cérébrales, en particulier de l’artère cérébrale
moyenne: une vélocité supérieure à 120cm.s-1 et/ ou l’augmentation d’une vélocité de 50cm.s-1.j-1 annoncent la
survenue d’un vasospasme symptomatique dans les 24 heures.
Sur le plan physiopathologique, de nombreuses inconnues demeurent. Toutefois il est accepté que la présence de sang
dans l’espace sous-arachnoïdien et les citernes de la base, favoriseraient le vasospasme. L’hémoglobine agirait par son
 6
6
 7
7
 8
8
1
/
8
100%