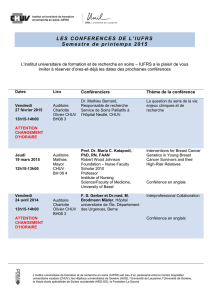
Concerne : Dosage des concentrations plasmatiques d

Lausanne, le 18 juin 2009
Concerne : Dosage des concentrations plasmatiques d’imatinib :
Uniquement lors de problèmes cliniques, ou déjà préventivement ?
Cher Confrère, Chère Consœur,
L’imatinib, le premier des anticancéreux ciblés, a révolutionné le traitement et le pronostic de la
leucémie myéloïde chronique (LMC). Cependant, des cas surviennent où ce traitement doit
être interrompu à cause d’une réponse insuffisante ou d’effets indésirables. Plusieurs études
de pharmacocinétique ont montré que des réponses insuffisantes sont associées à des
concentrations plasmatiques d’imatinib plutôt basses, alors que des effets indésirables
importants sont observés en présence de concentrations plutôt élevées.
La pharmacocinétique de l’imatinib étant éminemment variable, une posologie donnée produit
des concentrations passablement différentes d’un patient à l’autre. Pour cette raison, le
monitoring des concentrations d’imatinib (Therapeutic drug monitoring, TDM) est
recommandé par plusieurs auteurs. On considère comme optimal un taux plasmatique aux
alentours de 1000 µg/l en fin d’intervalle de dosage. Divers laboratoires d’analyses européens,
parmi lesquels notre laboratoire de Pharmacologie et Toxicologie cliniques du CHUV,
proposent ce dosage depuis quelque temps. Cependant, son utilité réelle et ses modalités
optimales sont encore en discussion.
Plutôt que de proposer simplement un nouveau dosage, il nous paraît donc souhaitable pour
un centre académique de développer cette offre de service dans le cadre d’une étude
prospective évaluant l’utilité clinique du monitoring de l’imatinib. Nous aimerions vous
inviter à y inclure vos patients recevant de l’imatinib pour une LMC.
Cette étude vise à comparer l’utilité clinique d’un TDM appliqué « en routine » pour ajuster
préventivement les posologies à la concentration recommandée de ~1000 µg/l, à un TDM
employé « en sauvetage » pour déterminer le taux plasmatique seulement chez les patients
qui présentent une réponse insuffisante ou des effets indésirables suggestifs de toxicité.
Division de Pharmacologie et Toxicologie cliniques
Hôpital Beaumont – 6
ème
étage
1011 Lausanne - CHUV
Tél. : 021 314 42 60
Fax : 021 314 42 66
Pr J. Biollaz, médecin chef
Dr T. Buclin, PD, MER, médecin-adjoint
Dr LA. Décosterd, PD, MER, chef de section de recherche
Dr E. Grouzmann, PD, MER, FAMH
Dr F. Livio, chef de clinique
Dr. L. Rothuizen, chef de clinique
À l’attention des
Hématologues prenant en charge
des patients LMC sous traitement
d’imatinib (Glivec
®
)

Concrètement, nous vous invitons simplement à prélever un échantillon sanguin pour ce
dosage chez tout patient recevant de l’imatinib et acceptant de participer à cette étude
dès sa prochaine consultation, indépendamment de tout doute quant à l’efficacité ou la toxicité
du traitement (cf. feuille d’information et formulaire de consentement annexés).
L’échantillon doit être prélevé au moins 4 heures après la dernière dose, selon les instructions
ci-jointes (cf. tube, emballage et instructions annexées), et envoyé à notre laboratoire
accompagné d’un bon de demande complètement rempli (annexé) ainsi que d’une copie des
résultats hématologiques, cytogénétiques et de réponse moléculaire mesurés durant la
dernière année.
A réception de cet échantillon, nous assignerons le patient à un groupe d’étude au hasard :
• Pour les patients du groupe intervention (TDM en routine), le dosage sera effectué
dans les 10 jours et vous recevrez le résultat, ainsi qu’une proposition d’adaptation
posologique si la concentration s’éloigne significativement de la cible recommandée de
1000 ng/ml. Le cas échéant, vous pourrez recontrôler la concentration après
ajustement de la posologie.
• Pour les patients du groupe contrôle (TDM de sauvetage), nous vous enverrons
simplement un avis de réception de l’échantillon et le dosage ne sera réalisé qu’à la fin
de l’étude.
Par la suite, pour les patients des deux groupes, vous pourrez en tout temps demander
un dosage en cas de réponse insuffisante ou de suspicion de toxicité. Vous recevrez
alors le résultat ainsi qu’une proposition d’adaptation posologique dans tous les cas.
Au bout d’une année, nous vous demanderons dans tous les cas de prélever un dernier
échantillon de fin d’étude, dont vous recevrez le résultat. L’étude vise à inclure 300 patients
pour déterminer si la stratégie de TDM en routine est bénéfique sur une année en termes de
réponse et de tolérance au traitement, par rapport au TDM de sauvetage déjà disponible.
Vos patients continueront d’être suivis dans votre cabinet et n’auront pas besoin d’être vus
ailleurs. Tous les dosages d’imatinib effectués dans le cadre de l’étude sont gratuits. Nous
sommes toutefois conscients que l’enrôlement de vos patients dans cette étude vous
occasionnera un surcroit de travail, qu’il ne serait pas adéquat de faire supporter par
l’assurance maladie. Il vous est donc possible de nous facturer ce travail à hauteur de 100.- Fr.
par patient pour le recueil du consentement et le prélèvement d’inclusion, et de 100.- Fr. pour
le prélèvement de fin d’étude (factures-type annexées). Les prélèvements intermédiaires
demandés en cas de problème sont considérés faire partie du suivi clinique du patient tel qu’il
serait effectué hors étude. Le coût du médicament reste à la charge de l’assurance.
En espérant que ce projet saura rencontrer votre intérêt, nous sommes à votre disposition en
cas de questions. Avec nos remerciements pour votre collaboration, nous vous prions d’agréer
nos salutations les meilleures.
Dr Thierry Buclin Dr Nicolas Widmer Dr Laurent A. Decosterd Verena Gotta
Médecin adjoint Pharmacien resp. TDM Responsable du laboratoire Coordinatrice du projet
Investigateur principal Co-investigateur Co-investigateur Co-investigatrice
Annexes :
Flyer résumant l’étude (anglais) ; feuille d’information au patient ; formulaire de consentement ;
instructions de prélèvement ; bon de demande de dosage ; tube et emballage ; factures-type pour les
actes liés à l’étude.
1
/
2
100%