RESUME DES CARACTERISTIQUES DU PRODUIT

RESUME DES CARACTERISTIQUES DU PRODUIT
&
NOTICE
SÉVORANE
1. DENOMINATION DU MEDICAMENT
SÉVORANE 100%, liquide pour inhalation par vapeur
SÉVORANE Quick Fill 100%, liquide pour inhalation par vapeur
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sévoflurane 100%
Pour la liste complète des excipients, voir rubrique 6.1
3. FORME PHARMACEUTIQUE
Liquide pour inhalation par vapeur.
Propriétés:
Sévoflurane est un dérivé fluoré de méthyl isopropyl éther. Sévoflurane est identifié chimiquement comme
fluorométhyl 2,2,2-trifluoro-1-(trifluorométhyl) éthyl éther et a un poids moléculaire de 200,05.
Sévoflurane possède les propriétés physiques et chimiques suivantes :
Point d'ébullition à 760 mm Hg 58,6°C
Densité à 20°C 1,520-1,525
Tension de vapeur
(calculée) en mm Hg** 157 mm Hg à 20°C
197 mm Hg à 25°C
317 mm Hg à 36°C
** Equation pour la tension de vapeur (calculée), mm Hg :
Log10Pvap = A+B/T
Où :
A = 8,086
B = -1726,68
T = °C + 273,16°K
(Kelvin)
Répartition des coéfficients de partage à 37°C :
Sang/Gaz 0,63-0,69
Eau/Gaz 0,36
Huile d'olive/Gaz 47,2-53,9
Cerveau/Gaz 1,15
Coéfficients de partage moyens Composant/Gaz à 25°C pour les polymères utilisés couramment en
applications médicales :
Caoutchouc conducteur 14,0
Caoutchouc butyl 7,7
Chlorure de polyvinyl 17,4
Polyéthylène 1,3
Sévoflurane est non-inflammable et non-explosif, comme défini par les normes de la Commission
Internationale d'Electrotechnique 601-2-13.
Sévoflurane est un liquide transparent et incolore.

Sévoflurane est non-irritant. Il est miscible à l'éthanol, l'éther, le chloroforme et le benzène et est
légèrement soluble dans l'eau.
Dégradation du sévoflurane
Sévoflurane est stable lorsqu'il est conservé dans des conditions d'éclairage normales. S Sévoflurane ne
subit aucune dégradation discernable en présence d'acides forts ou de chaleur.
Sévoflurane n'est pas corrosif pour l'acier inoxydable, le cuivre, l'aluminium, le cuivre nickelé, le cuivre
chromé ou l'alliage cuivre-béryllium.
Une réaction de dégradation peut se produire au contact direct avec des absorbants du CO2 dans le
circuit d’anesthésie. Lors d’une utilisation avec des absorbeurs frais (conforme aux recommendations), la
dégradation du sévoflurane est minimale, et les produits de dégradation ne sont pas détectables ou
toxiques.
Une dégradation accrue est observée avec une température croissante de l'absorbant, avec un absorbeur
desséché (particulièrement ceux à base d’hydroxide de potassium), avec des concentrations croissantes
de sévoflurane et avec une réduction du débit en gaz frais.
sévofluranepeut subir une dégradation alcaline de deux façons. La première résulte de la perte d’acide
fluorique et la formation de pentafluoroisopropanyl fluoromethylether (mieux connu comme composé A).
La deuxième se produit seulement en présence d’absorbants CO2 desséchés et entraîne la dissociation
de sévoflurane en hexafluoroisopropanol (HFIP) et formaldéhyde. Le HFIP est inactif, non-génotoxique,
rapidement glucuroné, éliminé, et sa toxicité est comparable au sévoflurane. Le formaldéhyde est un
composant présent pendant des réactions métaboliques normales.
Lors d’une exposition à un absorbant fortement desséché, le formaldéhyde peut dégrader avec formation
de méthanol et de formate. A hautes températures, le formate peut contribuer à la formation de monoxyde
de carbone. Le méthanol peut réagir avec le composé A pour former le composé B, qui peut subir une
perte successive d’acide fluorique pour former les composés C, D et E (voir section 4.4). Avec des
absorbeurs très desséchés, en particulier ceux contenant de l’hydroxide de potassium, on peut assister à
la formation de formaldéhyde, de méthanol, de monoxyde de carbone, du Composé A et éventuellement
de certains de ses produits de dégradation, les Composés B, C, et D.
Dégradation de l’acide de Lewis
SÉVORANE contient au moins 300 ppm d’eau afin de le protéger contre des acides Lewis du milieu
ambiant. D’autres additifs ou stabilisateurs chimiques ne sont pas utilisés.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Sévoflurane est indiqué pour l'induction et le maintien de l'anesthésie générale chez le patient adulte et
pédiatrique pour la chirurgie de patients ambulatoires ou hospitalisés.
4.2 Posologie et mode d’administration
Posologie
La prémédication doit être sélectionnée en fonction des besoins du patient individuel et selon l’avis de
l’anesthésiste.
Mode d’administration
Le sévoflurane doit être délivré au moyen d'un vaporisateur calibré spécifiquement pour l'usage du
sévoflurane de telle façon que la concentration délivrée puisse être contrôlée avec précision.
Induction :
La posologie doit être individualisée et titrée jusqu'à l'effet désiré selon l'âge du patient et son état
clinique. Un barbiturique à action courte ou un autre agent d'induction intraveineux peut être administré
avant l'inhalation du sévoflurane. Pour l'induction d’une anesthésie par le sévoflurane, des gaz porteurs

tels que l’oxygène seul ou un mélange d’oxygène/protoxyde d'azote peuvent être utilisés. Chez l'adulte
ainsi que l’enfant, des concentrations inhalées jusqu'à 8% de sévoflurane produisent généralement une
anesthésie chirurgicale en moins de 2 minutes.
Maintien :
Une anesthésie chirurgicale peut être maintenue avec des concentrations de 0,5-3% de sévoflurane avec
ou sans utilisation concomitante de protoxyde d'azote.
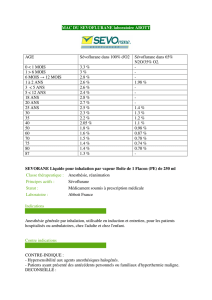
Les valeurs de M.A.C. (concentrations alvéolaires minimum) pour le sévoflurane décroissent avec l'âge et
l'addition de protoxyde d'azote.
Le tableau ci-dessous indique les valeurs moyennes de M.A.C. pour différents groupes d'âge.
EFFET DE L'AGE SUR LE M.A.C. DE SEVOFLURANE
Age des patients
(années)
sévoflurane dans
100% d'oxygène
sévoflurane dans
65%N2O/ 35%O2 **
0-1 mois* 3,3% Non disponible
1mois-<6 mois 3% Non disponible
6 mois-3 ans 2,8% 2%
3-12 2,5% Non disponible
25 2,6% 1,4%
40 2,1% 1,1%
60 1,7% 0,9%
80 1,4% 0,7%
* Chez les nouveaux-nés à terme. MAC des prématurés n’a pas été determiné.
** Chez les patients pédiatriques de 1-<3ans, on a utilisé 60% N2O/40% O2
Réveil :
Les temps de réveil sont généralement courts après une anesthésie par le sévoflurane. Il s'ensuit que les
patients peuvent nécessiter un soulagement des douleurs post-opératoires plus précocement.
Personnes âgées :
Comme avec d'autres agents d'inhalation, des concentrations plus faibles de sévoflurane sont
normalement requises pour maintenir l'anesthésie chirurgicale.
Population pédiatrique
Voir tableau 1 pour les valeurs de M.A.C. pour les patients pédiatriques en fonction de l’âge.
4.3 Contre-indications
- Prédisposition génétique connue ou suspectée à l’hyperthermie maligne.
- sensibilité connue ou suspectée au sévoflurane ou à d’autres anesthésiques halogénés (p. ex.
antécédents de troubles de la fonction hépatique, de fièvre, de leucocytose de cause inconnue
et/ou d’éosinophilie après une anesthésie avec l’un de ces agents).
- contre-indication à l’anesthésie générale
4.4 Mises en garde spéciales et précautions d’emploi
Le sévoflurane peut induire une dépression respiratoire, qui peut être aggravée par une prémédication
narcotique ou d'autres agents provoquant une dépression respiratoire (voir la rubrique 4.5). La fonction
respiratoire doit être surveillée et si nécessaire, assistée.

Le sévoflurane ne peut être administré que par des personnes qualifiées pour l'application d'une
anesthésie générale. Des équipements pour l'intubation, la ventilation artificielle, l'enrichissement en
oxygène et la réanimation circulatoire doivent être immédiatement disponibles.
La concentration de sévoflurane delivrée par un vaporisateur doit être connue de manière exacte. Etant
donné que les anesthésiques volatils diffèrent selon leurs propriétés physiques, le sévoflurane doit être
délivré au moyen d'un vaporisateur calibré spécifiquement pour l'usage du sévoflurane. L’administration
d’une anesthésie générale doit être adaptée en fonction de la réponse individuelle du patient.
L’hypotension et la dépression respiratoire augmentent avec la profondeur de l’anesthésie.
Des cas isolés de prolongation de l’intervalle QT, rarement associé avec torsade de pointes (fatal dans
des cas exceptionnelles) ont été rapportés. La prudence doit être de mise en administrant le sévoflurane
aux patients sensibles.
Des cas isolés d’arythmie ventriculaire ont été rapportés chez des patients pédiatriques souffrant de la
maladie de Pompe (glycogénose de type II de Cori).
La prudence doit être de mise en administrant une anesthésie générale, inclus le sévoflurane, aux
patients ayant une affection mitochondriale.
Troubles hépatiques :
De très rares cas légers, modérés et sévères de dysfonction hépatique postopératoire ou d’hépatite avec
ou sans ictère ont été rapportés au cours de l’expérience post-marketing.
Une évaluation clinique est de rigueur en cas d'utilisation de sévoflurane chez des patients ayant des
affections hépatiques sous-jacentes ou recevant un traitement par des médicaments connus pour induire
une dysfonction hépatique (voir rubrique 4.8).
Il a été rapporté qu’une exposition précédente aux hydrocarbures halogénés, particulièrement si l’interval
est de moins de 3 mois, pourrait augmenter le risque de lésions hépatiques.
Hyperthermie maligne :
Chez les individus prédisposés, les agents anesthésiques par inhalation puissants peuvent déclencher un
état hypermétabolique des muscles squelettiques conduisant à une haute demande en oxygène et au
syndrome clinique connu sous le nom d'hyperthermie maligne. Le syndrome clinique est signalé par une
hypercapnie, et peut inclure une rigidité musculaire, une tachycardie, une tachypnée, une cyanose, des
arythmies et/ou une tension artérielle instable. Certains de ces signes non spécifiques peuvent également
apparaître pendant une anesthésie légère, une hypoxie aiguë, une hypercapnie et une hypovolémie.
Un cas d'hyperthermie maligne a été rapporté dans les études cliniques. En plus, il y a également eu des
rapports d'hyperthermie maligne après la commercialisation, dont certains avec une issue fatale.
Le traitement comprend l'arrêt de l'agent déclenchant (p.e. le sévoflurane), l'administration par voie
intraveineuse de dantrolène sodique (pour des informations supplémentaires concernant la prise en
charge du patient, consultez les informations de prescription du dantrolène sodique par voie
intraveineuse), et la mise en oeuvre d'une thérapie de soutien. Une telle thérapie comprend des efforts
rigoureux pour rétablir la température corporelle à la normale, un support respiratoire et circulatoire selon
les besoins, et la gestion d’anormalités de l'équilibre hydrique, électrolytique et acido-basique. Une
insuffisance rénale peut apparaître ultérieurement et le débit urinaire doit être surveillé et maintenu si
possible.
Hyperkaliémie peropératoire :
L’utilisation d’anesthésiques par inhalation a rarement été associée à une hyperkaliémie, ayant conduit à
des arythmies cardiaques et à des décès chez des enfants pendant la phase post-opératoire. Les patients
les plus vulnérables sont ceux atteints d’une maladie neuro-musculaire latente ou déclarée (en particulier
une dystrophie musculaire type Duchenne). Dans la majorité des cas, l’utilisation concomitante de la
succinylcholine était observée.
Une augmentation des taux de la créatine kinase sérique et, dans quelques cas, un myoglobinurie ont
également été observées chez ces patients. En dépit de la similarité de présentation de l’hyperthermie
maligne, des signes et symptômes de rigidité musculaire ou d’un état hypermétabolique n’ont cependant

pas été observés. Un traitement rapide et énergique de l’hyperkaliémie et des arythmies persistantes est
recommandé, ainsi que l’évaluation de la présence d’une maladie neuromusculaire latente.
Informations générales :
Pendant le maintien de l'anesthésie, l'augmentation de la concentration de sévoflurane produit une
diminution dose-dépendante de la tension artérielle. Une diminution excessive de la tension artérielle peut
être mise en relation avec la profondeur de l'anesthésie et, en de telles circonstances, peut être corrigée
par la diminution de la concentration inhalée de sévoflurane. Une prudence particulière est de rigueur
lorsqu’on détermine la posologie chez des patients présentant une hypovolémie, une hypotension ou tout
autre trouble hémodynamique, p. ex. secondaire à des traitements concomitants.
Comme avec tous les anesthésiques, le maintien de la stabilité hémodynamique est important pour éviter
une ischémie myocardiale chez des patients souffrant de maladie coronarienne.
La reprise de connaissance de l'anesthésie générale doit être prudemment surveillée avant que les
patients ne quittent la salle de réveil.
Bien que l’on observe généralement une reprise de conscience quelques minutes qu’après
l’administration du sévoflurane, l’effet sur la fonction intellectuelle pendant les deux à trois jours qui
suivent l’anesthésie n’a pas été étudié. Comme avec d’autres anesthésiques, de petites modifications de
l’humeur peuvent persister plusieurs jours après l’administration (voir rubrique 4.7).
Remplacement des absorbeurs de CO2 :
Des rares cas d’extrême chaleur, de fumée et/ou d’incendie spontané ont été signalés dans l’appareil
d’anesthésie lorsque le sévoflurane est utilisé avec un absorbeur de CO2 desséché, particulièrement à
base d’hydroxide de potassium. Dans ces cas, une augmentation anormalement retardée ou une
diminution inattendue de la concentration de sévoflurane inspirée par rapport au réglage du vaporisateur
peut être associée à un échauffement excessif de l’absorbeur de CO2.
Une réaction exothermique, une dégradation accrue du sévoflurane et une production de produits de
dégradation peut se produire, lorsque l’absorbeur de CO2 commence à être desséché, par exemple après
une période prolongée d’écoulement de gaz sec au travers de l’absorbeur de CO2 (voir section
« propriétés »).
Des produits de dégradation de sévoflurane (méthanol, formaldéhyde, monoxyde de carbone, et les
composés A, B, C et D) ont été observés dans le circuit respiratoire d’un appareil d’anesthésie
expérimental, utilisant des absorbeurs CO2 desséchés et des concentrations maximales de sévoflurane
(8%) pendant des périodes prolongées (≥ 2 heures). Il est connu que les concentrations de
formaldéhyde, observées dans le circuit respiratoire de l’appareil (utilisant de l’hydroxide de sodium
comme absorbeur) peuvent être à l’origine d’une irritation respiratoire légère. La pertinence clinique des
produits de dégradation observés dans le model expérimental extrême n’est pas connue.
Il faut remplacer l’absorbeur de CO2 si l’on suspecte un problème de dessiccation avant l’administration
de sévoflurane. L’indicateur coloré de la plupart des absorbeurs de CO2 ne change pas nécessairement
suite à la dessiccation. Par conséquent, l’absence de changement de couleur significatif ne doit pas être
considéré comme la garantie d’une hydratation suffisante. Les absorbeurs de CO2 doivent être remplacés
régulièrement, cela indépendamment de l’état de l’indicateur coloré.
Veillez donc à toujours respecter les règles de bonne pratique clinique en ce qui concerne l’entretien des
appareils d’anesthésie et l’utilisation d’absorbeurs de CO2 :
- Remplacez l’absorbeur de CO2 si vous suspectez un problème de dessiccation ou après une longue
période de non-utilisation. Fermez également tous les vaporisateurs lorsqu’ils ne sont pas utilisés et
coupez l’arrivée de gaz dans l’appareil d’anesthésie à la fin de chaque utilisation clinique ou chaque fois
que l’on prévoit une période prolongée de non-utilisation.
- Contrôlez la corrélation entre le réglage du vaporisateur de sévoflurane et la concentration de
sévoflurane inspirée. Une augmentation anormalement retardée ou une diminution inattendue de la
concentration de sévoflurane inspirée par rapport au réglage du vaporisateur peut être associée à un
chauffage excessif de l’absorbeur de CO2.
- Production d’une extrême chaleur dans l’appareil d’anesthésie suivant un échauffement excessif de
l’absorbeur de CO2 pourrait mener à un échec de l’induction de l’inhalation ou une anesthésie
insuffisamment profonde par le sévoflurane. Irritation des voies respiratoires, désaturation en oxygène,
augmentation de la pression au niveau des voies respiratoires et ventilation difficile, oedème sévère au
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%