Thème 3B Activité : Nature et propagation du message nerveux

1
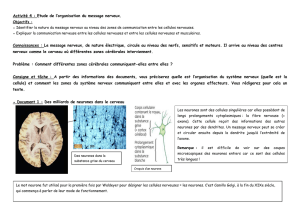
A partir des documents proposés et vos connaissances, montrer que le message nerveux est de nature bio-électrique (ou chimio-électrique).
Document 1 : Enregistrement d’activités électriques de nerfs par ExAO (http://espace-svt.ac-rennes.fr/applic/neuro/neuro.htm)
Document 2 : Etude de l’activité électrique d’un neurone par le logiciel de simulation « Nerf »
1. Le dispositif expérimental (modules 1 et 2)
1.1. Préciser les appareils permettant l’enregistrement et la visualisation de l’activité électrique d’un neurone.
1.2. Faire un schéma légendé du dispositif expérimental.
2. Le potentiel de repos (modules 2 et 4)
On dit qu'une cellule est au repos lorsqu'elle n'est pas stimulée.
2.1. Faire entrer une électrode dans le cytoplasme du neurone et placer l’autre sur la membrane. Observer et interpréter.
2.2. Mesurer le potentiel de repos d’une cellule.
3. Le potentiel d'action (ou PA) (modules 1 et 2)
3.1. Effectuer des stimulations faible, moyenne puis forte. Observer et recopier les tracés obtenus en superposition.
3.2. Suite à une stimulation moyenne ou forte, on enregistre un potentiel d'action (ou PA). Décrire ce phénomène (amplitude, durée).
4. La propagation du PA (modules 3)
Il existe deux types de neurones :
- Des neurones dont l'axone est entouré d'une gaine de myéline (fibres myélinisées)
- Des neurones dont l'axone est dépourvu de gaine de myéline (fibres amyélinisées)
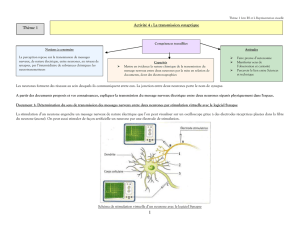
Activité : Nature et propagation du message nerveux
Thème 3B
Compétences travaillées
Notions à construire
Les signaux émis par les neurones sont des potentiels d’action.
La genèse d’un potentiel d’action repose sur l’existence d’un potentiel de repos (ddp).
Le potentiel d’action est une inversion transitoire de la polarisation membranaire. Au
cours de sa propagation le long d’une fibre, le potentiel d’action conserve toutes ses
caractéristiques.
Les messages nerveux se traduisent au niveau d’une fibre par des trains de potentiels
d’action, d’amplitude constante.
Les messages nerveux sont codés par la fréquence des potentiels d’action et le
nombre de fibres mises en jeu
La commande de la contraction met en jeu le fonctionnement de la synapse
neuromusculaire.
Un message nerveux est transmis d’un neurone à d’autres neurones ou des cellules
effectrices par des synapses.
Au niveau d’une synapse, le message nerveux pré-synaptique, codé en fréquence de
PA, est traduit en message chimique codé en concentration de neurotransmetteur.
Les molécules de neurotransmetteurs se fixent sur des récepteurs de la membrane
post-synaptique. Cette fixation induit une modification de l’activité du neurone post-
synaptique qui est à l’origine d’un nouveau message.
Capacités
Recenser, extraire et exploiter des informations, afin de caractériser la
nature et la propagation du message nerveux
Recenser, extraire et exploiter des informations, afin de caractériser le
fonctionnement d'une synapse chimique.
Interpréter les effets de substances pharmacologiques sur le
fonctionnement de synapses chimiques.
Attitudes
Faire preuve d’autonomie et de
curiosité
Être conscient de sa responsabilité
face à la santé
Avoir une bonne maîtrise de son corps

2
4.1. Stimuler l'une des fibres nerveuses. Observer.
4.2. Comparer la vitesse de propagation d'un PA sur les deux types de fibres nerveuses.
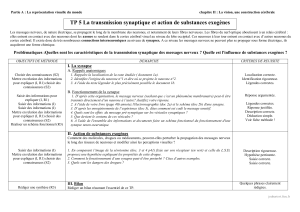
5. Le codage du message nerveux électrique (modules 5 et 6)
Les potentiels d’action sont les mêmes quelque soit l’intensité de la stimulation.
Dans le module 5, on réalise une expérience sur une seule fibre nerveuse (une seule cellule = 1 neurone).
5.1. Préciser la nature du stimulus et le récepteur sensoriel stimulé.
5.2. Préciser comment l'intensité de la stimulation est-elle codée au niveau de la fibre nerveuse.
Dans le module 6, on réalise une expérience sur un nerf (nombreuses fibres nerveuses).
5.3. Préciser comment l'intensité de la stimulation est-elle codée au niveau d'un nerf. Faire un schéma légendé des résultats enregistrés.
5.4. Proposer une explication aux résultats enregistrés sur le nerf.
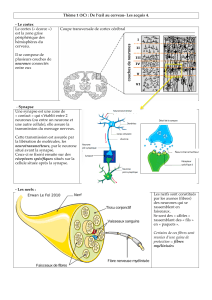
Document 3 : Électronophotographies de synapses (MET , à gauche x 100 000 et à droite x 500 000)

3
Document 4 : La nature chimique de la transmission du message nerveux entre deux neurones
Dans les années 1840, Claude Bernard et Alfred Vulpian montrent qu’un composé chimique, le curare, utilisé pour la chasse par les amérindiens qui en enduisent la pointe de
leur fléchette, agit au niveau de la jonction entre les neurones et les cellules des muscles qui ne sont plus alors capables de se contracter. Ils en concluent qu’un intermédiaire
chimique doit être présent lors du passage normal du message nerveux de la contraction musculaire entre les neurones et les cellules musculaires.
En 1897, Sherrington appelle synapse (du grec sunapsis jonction) la jonction entre deux neurones.
En 1936, le prix Nobel de médecine est atribué à Henry Dale Hallett et Otto Loewi pour leurs découvertes relatives à la transmission chimique de l’influx nerveux : ils ont
caractérisé les substances chimiques impliquées dans le passage du message nerveux d’un neurone à l’autre : les neurotransmetteurs.
http://lyc58-romain-rolland.ac-dijon.fr/Pedago/TPE/Curare/action.htm
Document 5 : La jonction neuromusculaire et la contraction musculaire (http://lecerveau.mcgill.ca/flash/i/i_06/i_06_m/i_06_m_mou/i_06_m_mou.html)
http://www.apteronote.com/revue/histoire/article_21.shtml
Document 6 : Etude de la transmission du message nerveux par le logiciel de simulation « Synapse »
La stimulation d’un neurone engendre un message nerveux de nature électrique que l’on peut visualiser
sur un oscilloscope grâce à des électrodes réceptrices placées dans la fibre du neurone (axone). On peut
aussi stimuler de façon artificielle un neurone par une électrode de stimulation.
Schéma de stimulation virtuelle d’un neurone avec le logiciel Synapse

4
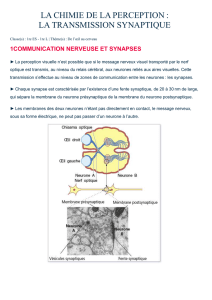
Document 7 : Schéma fonctionnel d'une synapse
Document 8 : Etude du codage du message nerveux chimique par micro-iontophorèse
La micro-iontophorèse est une technique permettant d’analyser le fonctionnement d’une synapse. Le neurotransmetteur est placé en solution en solution dans une
micropipette. Un courant électrique appelé micro-iontophorèse traverse la pipette et permet d’injecter des quantités très faible de neurotransmetteurs dans la fente
synaptique. L’intensité et la durée de ce courant déterminent la quantité de solution injectée donc de neurotransmetteurs injectés.
Sur des neurones du cortex de l’encéphale du rat, on mesure l’évolution de la fréquence de potentiels d’action du neurone post-synaptique en fonction du temps, pour des
courants de micro-ionophorèse d’intensité donnée, et donc pour des quantités données du neurotransmetteur libérées dans la fente synaptique.
1
/
4
100%