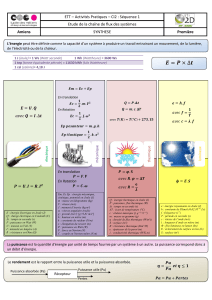
Premier principe de thermodynamique.

∆E= ∆Em+ ∆U=W+Q
•
•
•
∆E
•
•
∆U=W+Q
•dU =δW +δQ
•H=U+P V dH =δW6=p+δQ
W6=p
•pext
dS δWp=−pext dSdx =−pext dV
•
p=pext
δWp=−p dV
⇒
δWp= 0
Wp=−p∆V
dH =δW6=p+δQ
dU =dH = 0 δW =−δQ
pV =cste δW =−pdV =−nRT dV
V=nRT dp
p
δW =δWp
=δQ

δQ = 0
pV γ=cste
dU =CVdT CV
dH =CpdT Cp
Cp
CV
=γ
CV=nR
γ−1Cp=nRγ
γ−1
dU =CVdT dH =CpdT CV=Cp=
C
T V γ−1=cste p1−γTγ=cste
1
/
2
100%